您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-02 11:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.同源康抗耐药性TKI疗法获批临床。浙江同源康医药自主研发的新一代抗耐药性ROS1/NTRK/ALK多靶点抑制剂TY-2136b获FDA临床许可。临床前研究显示,TY-2136b可覆盖ROS1/NTRK/ALK突变引起的癌症,可同时克服G2032R、G595R、G667C、 G623R、G696A和G1202R等及潜在双突变产生的耐药性。该公司计划同步在中美两国开展Ⅰ期临床,评估TY-2136b用于治疗NTRK1/2/3、ROS1或ALK基因融合晚期实体瘤的安全性、耐受性和药代动力学特征以及初步的疗效。
2.甘李药业周制剂胰岛素报IND。甘李药业每周一次超长效胰岛素周制剂GZR4的临床试验申请获NMPA受理。目前已上市长效基础胰岛素类似物半衰期大约都在10~26小时。超长效胰岛素周制剂具有半衰期更长、给药频率低、血药浓度与药效更加平稳,血糖日间变异小,低血糖风险更小等特点。目前全球尚无胰岛素周制剂获批上市;诺和诺德Icodec(Insulin 287)是同类产品研发进展最快,处于III期临床阶段。
3.上海君实Aurora A抑制剂报IND。君实生物与微境生物的合资公司君境生物申报的Aurora A抑制剂WJ05129片(JS112)的临床试验申请获NMPA受理。S112是一种口服小分子Aurora A抑制剂,与RB1基因缺失或失活具有合成致死的效果,拟开发用于治疗小细胞肺癌和三阴乳腺癌等RB1缺失或失活的恶性肿瘤。目前,全球尚无Aurora A抑制剂获批上市。进展最快的是武田的alisertib,用于非小细胞肺癌适应症处于II期临床阶段。
4.上海洛启雾化IL-4R纳米单抗报IND。洛启生物自主研发的重组抗IL-4Ra单抗雾化液(LQ036)的临床试验申请获CDE受理。LQ036为一款IL-4R纳米单抗,拟用于重度哮喘等呼吸系统疾病的治疗。LQ036采用雾化给药,可以直达肺部病灶,能够有效避免肝脏的首过效应,避免皮下给药的潜在副作用。目前,LQ036正在澳大利亚开展I期临床研究。
5.恒瑞医药与慕恩生物达成临床合作。恒瑞医药PD-L1阿得贝利单抗拟联合慕恩生物抗肿瘤活菌药物MNC-168开展临床研究,评估联合用药在既往使用PD-1/PD-L1抑制剂进展后的多种晚期恶性肿瘤患者中的安全性、耐受性以及抗肿瘤疗效。阿得贝利单抗与化疗联用已在一线治疗广泛期小细胞肺癌的Ⅲ期临床(SHR-1316-III-301)中取得积极结果。在临床前研究中,MNC-168也在多种肿瘤模型中显著提高免疫检查点抑制剂的应答率。
国际药讯
1.默沙东新冠口服药EUA获FDA批准。FDA药物咨询委员会以微弱优势13:10推荐批准默沙东与Ridgeback Biotherapeutics联合开发的口服抗新冠药物Molnupiravir(MK-4482)紧急授权许可。Molnupiravir是一款强力核糖核苷类似物,已在英国获批用于治疗轻中度新冠患者,商品名为Lagevrio。molnupiravir也是全球首个获批的口服抗新冠病毒疗法。在Ⅲ期临床MOVe-OUT中,Molnupiravir治疗轻中度新冠患者的有效率为30%。
2.Opdivo在日本获批一线治疗胃癌和食管癌。日本厚生劳动省批准小野制药与百时美施贵宝联合开发的PD-1疗法Opdivo(nivolumab)新适应症,联合化疗用于一线治疗不可切除性晚期或复发性胃癌,以及用于辅助治疗食管癌。此次批准是基于2项临床研究的积极结果。其中Ⅲ期研究CheckMate-649结果显示,在合并阳性评分(CPS)≥5分的PD-L1阳性患者中,Opdivo+化疗显著延长患者的总生存期和无进展生存期。
3.即用型T细胞免疫疗法在欧洲报MAA。Atara Biotherapeutics公司即用型同种异体T细胞免疫疗法tabelecleucel(tab-cel)的上市许可申请(MAA)获欧洲药品管理局受理,用于治疗EB病毒(EBV)相关的移植后淋巴增殖性疾病(EBV+PTLD)。在一项Ⅲ期临床中,tabelecleucel在38例可评估患者中的平均ORR达到50%(19/38,95% CI:33.4,66.6)。FDA此前已授予tab-cel用于治疗同种异体造血细胞移植(HCT)后EBV+PTLD的突破性疗法认定。
4.辉瑞拟提高口服抗新冠药物产能。辉瑞日前宣布将提升其新冠病毒3CL蛋白酶抑制剂口服疗法Paxlovid™(PF-07321332+ritonavir) 的产能,预计到2022年底将生产8000万疗程的Paxlovid。该公司同时表示,将投资高达10亿美元来支持COVID药物的制造和分销,包括可能与合同制造商签约。临床试验显示,Paxlovid降低了COVID-19门诊患者的住院或死亡风险89%。目前,该新药已向FDA递交了紧急使用授权申请。
5.创新老花眼滴眼液Ⅱ期临床积极。Visus公司创新滴眼液Brimochol(carbachol+brimonidine)治疗老花眼患者的Ⅱ期临床达到主要终点。两种配方的Brimochol和活性对照(卡巴胆碱F配方)组中,至少83%的受试者治疗1小时内,检测近视力的指标DCNVA提高至少3行,并且远视力指标的降低少于1行。三组中分别有至少82%、52%和35%的受试者在3、7和9小时达到相同终点。临床中,未发生非预期不良事件。
6.创新FRα-ADC卵巢癌关键Ⅲ期临床积极。ImmunoGen公司靶向叶酸受体α(FRα)的抗体偶联药物(ADCs)mirvetuximab soravtansine在治疗晚期卵巢癌经治患者的关键Ⅲ期临床获积极结果。在中位随访8.1个月时,该新药达到32.4%的ORR(95% CI:23.6%,42.2%);中位缓解持续时间(DOR)为5.9个月(95% CI:5.6,7.7);而且药物耐受良好,其安全性特征与既往研究一致。该公司计划明年第一季度向FDA提交BLA。
医药热点
1.香港大学成功分离奥密克戎毒株。香港大学微生物学系于11月30日宣布成功从临床标本中分离出新冠变异病毒奥密克戎毒株。目前研究团队正在对该病毒株进行进一步的分离与培养。培养出来的病毒将用于动物模型,以评估其传播性、免疫逃逸性和致病性;也将用于开发和生产灭活全病毒疫苗。这是亚洲首个研究团队成功分离和培养奥密克戎毒株。
2.毒蕈碱M1受体激动剂治疗AD有戏。由英国格拉斯哥大学(Glasgow)和生物技术公司Sosei Heptares Ltd共同合作的一项研究于近日发表在Cell杂志上。研究人员基于结构的SBDD药物设计方式,筛选出一款毒蕈碱M1受体激动剂HTL9936。HTL9936能够特异性地靶向大脑中的M1毒蕈碱乙酰胆碱受体,进而激活大脑内的记忆和认知中心,有望开发成改善阿尔茨海默病(AD)患者认知功能的新型药物。
3.北京大学人民医院通州院区即将开诊。北京大学人民医院发布消息称,2021年12月18日,北京大学人民医院通州院区正式开诊并启用。为配合北京市城市副中心建设整体规划,北京大学人民医院于2017年与通州区政府合作,于漷县镇设置通州院区,一期规划占地面积11.9万平方米,开放床位800张。
评审动态
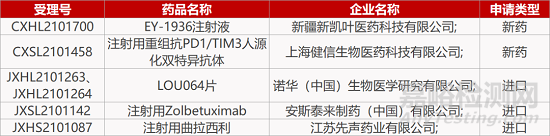
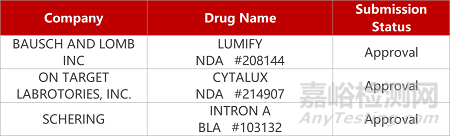

来源:药研发


