您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-10 11:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
重庆复创URAT1抑制剂获批临床。重庆复创医药1类新药FCN-342片获国家药监局临床试验默示许可。FCN-342是一款URAT1抑制剂,拟用于痛风、高尿酸血症治疗。URAT1通过介导尿酸与近曲小管上皮细胞内无机阴离子(Cl-)和有机阴离子(乳酸盐)的交换从而将尿酸从管腔内重吸收至上皮细胞内。URAT1转运体对尿酸盐的转运起到重要作用,是最主要的尿酸重吸收转运体。
国内药讯
1.祐和医药4-1BB单抗获批临床。百奥赛图旗下祐和医药1类新药YH004的临床试验申请获CDE受理。YH004是一款新型4-1BB单抗,可诱导免疫细胞增殖,细胞因子表达以激活机体免疫反应。在临床前研究中,YH004在小鼠体内已显示出单药及联用药效均明显优于对照药物;在食蟹猴体内毒理试验中,未观测到YH004具有肝毒性。
2.抗社交焦虑症新药国内报IND。艾迈医疗鼻用喷雾剂PH94B的临床试验申请获CDE受理。PH94B是VistaGen公司开发的一款潜在“first-in-class”、速效神经类固醇候选药物,具有治疗多种焦虑相关疾病的潜力。FDA此前已授予PH94B用于治疗社交焦虑症(SAD)的快速通道资格,该适应症开发目前已进入Ⅲ期临床。艾迈医疗拥有PH94B在大中华区、韩国和东南亚地区的开发和商业化权益。
3.信达PD-1/CD137双抗临床前研究积极。信达生物PD-1/CD137双抗IBI319的临床前研究成果发表在Nature子刊Nature Communications上。在CT26和MC38小鼠模型中,IBI319显示增强PD-1药效活性,同时激活CD137信号的协同效应,促进T细胞和NK细胞的肿瘤浸润,且没有如在PD-1和CD137单抗联用组中显示的肝毒性。食蟹猴的毒理实验中,IBI319显示安全性良好,无肝毒性等副作用。IBI319是信达和礼来合作的三款双抗之一,在国内处于I期临床阶段。
4.歌礼获得恩沃利单抗的抗病毒全球权益。歌礼与康宁杰瑞就后者皮下注射的PD-L1抗体药物ASC22(恩沃利单抗)签署合作许可协议,歌礼将获得ASC22(KN035)在大中华区以外治疗包括乙型肝炎在内的所有病毒性疾病的全球独家开发协议。连同2019年1月签署的大中华区独家开发协议,康宁杰瑞已授予歌礼ASC22用于治疗包括乙型肝炎在内的所有病毒性疾病的开发和商业化的全球独家权益。该新药的肿瘤适应症由康宁杰瑞开发,其上市申请已于去年年底向NMPA递交。
5.亚盛医药与辉瑞达成乳腺癌临床合作。亚盛医药Bcl-2选择性抑制剂lisaftoclax(APG-2575)与辉瑞CDK4/6抑制剂爱博新®(哌柏西利)将开展一项国际Ib/II期剂量扩展爬坡研究,评估联合用药治疗ER+/HER2-局部晚期或转移/复发性乳腺癌的安全性、耐受性和抗肿瘤活性。亚盛医药目前正在美国、欧洲、中国及澳大利亚同步推进APG-2575用于治疗多种血液肿瘤的临床开发。
国际药讯
1.达普司他治疗肾病贫血Ⅲ期临床成功。葛兰素史克在2021年美国肾脏病学会肾脏周上公布新型口服HIF-PHI疗法daprodustat(达普司他)治疗慢性肾病贫血的两项III期临床积极结果。在透析依赖和非透析患者中,与促红细胞生成素(ESA)相比,daprodustat显示出积极的疗效,且并未增加心血管风险。在ASCEND-ND试验中,风险比HR为1.03,95%CI:0.89~1.19。在ASCEND-D试验中,风险比HR为0.93,95%CI:0.81~1.07。该公司计划明年上半年向FDA提交NDA申请。
2.血友病创新RNAi疗法Ⅲ期临床积极。赛诺菲与Alnylam公司联合开发的RNAi疗法fitusiran在治疗血友病A和血友病B的Ⅲ期临床中获积极结果。与旁路制剂(bypassing agent)相比,fitusiran显著降低需要治疗的自发出血、关节出血和总出血的年出血率(ABR)。Fitusiran组ABR为0的患者比例达到65.8%。在携带抑制物的血友病A和B患者中,预防性fitusiran治疗均产生疗效。具体数据将在ASH2021年会上公布。
3.IDH1抑制剂治疗白血病Ⅲ期临床积极。施维雅口服选择性IDH1抑制剂Tibsovo(ivosidenib)联合阿扎胞苷(azacitidine)一线治疗IDH1突变、急性髓系白血病(AML)的Ⅲ期临床结果积极。与安慰剂+阿扎胞苷方案相比,这一组合显著延长患者的无事件生存期(EFS)(HR=0.33 [95% CI 0.16, 0.69];P=0.0011),提高患者总生存期(中位OS:24.0个月vs7.9个月(HR=0.44,p=0.0005)和完全缓解率(47.2%vs14.9%,p<0.0001)。具体数据将在ASH2021年会上公布。
4.诺和诺德司美格鲁肽Ⅲb期临床积极。诺和诺德在ObesityWeek® 2021大会上公布司美格鲁肽Wegovy(2.4mg皮下注射剂)治疗肥胖(BMI≥30kg/m2)或超重(BMI≥27kg/m2)的Ⅲb期临床(STEP 5)2年疗效数据。在配合饮食和运动基础上,与安慰剂组相比,Wegovy组患者从基线至第104周体重显著减轻(-15.2%vs-2.6%;[95%CI:-15.3,-9.8];p<0.0001);Wegovy治疗组体重减轻≥5%的患者比例更高(77.1%vs34.4%;p<0.0001);而且Wegovy的安全性与之前研究一致。
5.创新RNAi疗法启动降血压Ⅱ期临床。Alnylam Pharmaceuticals公司开发的靶向表达血管紧张素原的mRNA的RNAi疗法zilebesiran(原名ALN-AGT),即将启动一项国际Ⅱ期临床,在标准抗高血压药物治疗不能充分控制血压的高血压患者中,评估zilebesiran伴随治疗的疗效和安全性。该项试验将入组800例患者,主要终点是接受zilebesiran(600 mg)治疗3个月后,患者24小时平均收缩压(SBP)较基线的变化。
6.瑞派替尼治疗胃肠间质瘤III期临床失败。Deciphera公司公布KIT/PDGFRα激酶抑制剂瑞派替尼Qinlock二线治疗胃肠道间质瘤(GIST)的III期临床最新结果。与舒尼替尼相比,Qinlock未能达到改善无进展生存期(PFS)的主要终点。经独立放射学审查确定,两组的mPFS分别为8.0个月和8.3个月(HR 1.05,p=0.715)。在KIT外显子11原发性突变亚组患者中,两组mPFS分别为8.3个月和7.0个月(HR 0.88, p=0.360)。
医药热点
1.国采续约政策出台。国家医保局日前发布《关于做好国家组织药品集中带量采购协议期满后接续工作的通知》指出,原则上所有国采药品协议期满后均应继续开展集中带量采购。对于集采续接,将通过询价、竞价、综合评价等方式确定中选企业和中选价格。上一轮集采时差额中选的品种:所在省上一轮中选价格不高于全国最低中选价1.5倍的,以所在省上一轮中选价格为基线向所有符合条件的企业开展询价;所在省上一轮中选价格高于全国最低中选价1.5倍的,以不高于全国最低中选价1.5倍为基线向所有符合条件的企业开展询价。
2.医保改革进展与成效结果公布。中国药学会和中国医保研究会联合发布《中国医保药品管理改革进展与成效蓝皮书》。《蓝皮书》显示,被调查的各医院2021年第1季度心血管系统药物使用量比2015年第1季度增加50%,然而同期的心血管系统药物使用金额减少了5.2%。医保药品改革通过推进药品国采等一系列举措,让433个新药好药进入医保目录,平均降价54%。分析结果显示,心血管系统疾病药物价格大幅下降,医保用更少的钱保障了更多的患者。
3.安斯泰来在北京设立大中华区总部。安斯泰来宣布将在北京设立大中华区总部。在原有安斯泰来制药(中国)的基础上,新设立安斯泰来(中国)投资公司和北京安斯泰来医药公司,共同推动安斯泰来在中国的发展。安斯泰来投资公司作为公司在大中华区的区域总部,负责统筹布局、战略决策、资源协同,为公司发展提供全方位支持。
评审动态
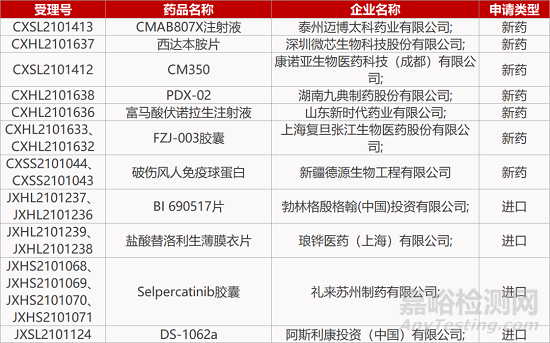
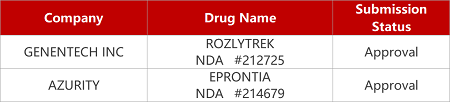

来源:药研发


