您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-10-22 21:57
摘要:本文介绍了国际监管科学创新中心(CIRS) 对国外六大主要监管机构批准的新活性物质 (New Active Substance,NAS) 的 年 度 分 析结果。六大监管机构包括:欧洲药品管理局 (EMA)、美国食品药品监督管理局(FDA)、日本药品和医疗器械综合机构(PMDA)、加拿大卫生部、瑞士医药管理局(Swissmedic)和澳大利亚药品管理局(TGA)。本项分析重点关注 2020 年以及 2011~2020 年的数据。尽管中位批 准时间可作为监管机构效能以及将新药推向市场所需时间的指标,但需要同时考虑其他因素。本文 重点关注了两项因素,即加速审评路径(facilitated regulatory pathways,FRP)和工作共享机制;通过工作共享机制,监管机构只需对申报资料中不 同的部分进行审评,以确保将新药快速推向全球市场。
关键信息
● 2020 年,FDA(CDER 和 CBER) 批准的 NAS 数量最多(图 1)。过去 10 年间,六大监管机构批准的 NAS 总量有所增长,但在过 去 5 年间趋于平稳;FDA 以外的其他监管机构批 准的数量仍持续增加。
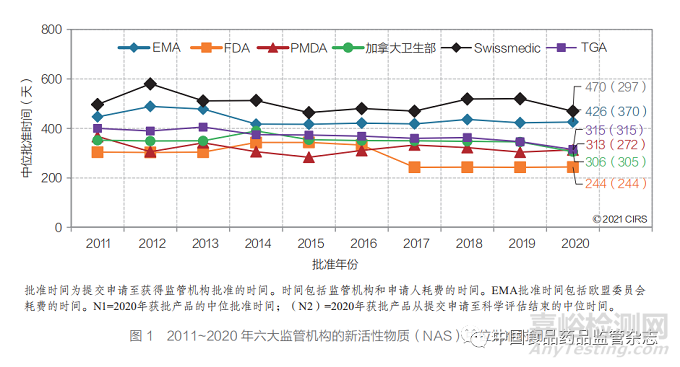
● 尽管在过去 20 年中的批准时间在近期出现 趋同,但六大监管机构的中位批准时间仍存在差 距,尤其是 EMA 和 Swissmedic 与其他四家机 构的差距较大。但是,从提交申请至科学评估结 束的中位时间之间的差距已大幅缩小。
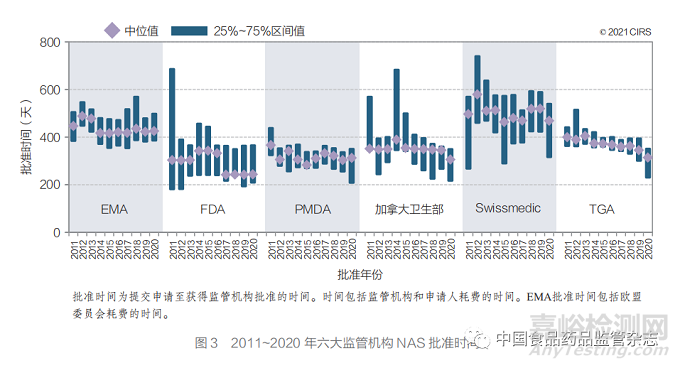
● FDA 的中位批准时间(244 天)最短, 这可能归因于加速审评路径(FRP)的广泛应 用。其 次 是 加 拿 大 卫 生 部(306 天 )、PMDA (313 天)、TGA(315 天)、EMA(426 天)和 Swissmedic(470 天)(图 2)。
● 六大监管机构均设置了加速审评体系,以 加快对有前景的 NAS 的审评程序(图 3)。TGA 在 2017 年实施了其优先审评体系,2018~2020 年 TGA 完成了 11 款加速审评。EMA 在 2020 年最初对 9 个 NAS 授予了加速审评资格;但后 来撤销了其中 6 款 NAS 的加速审评资格。此外, 申请人要求加速审评 7 款 NAS,但 EMA 未予 同意。
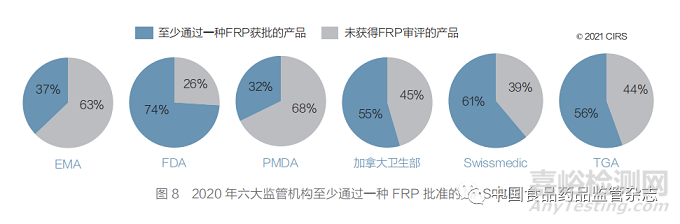
● FDA 通过 FRP 批准的 NAS 数量最多, 以加速药物能够获得审评、批准和上市,解决未 被满足的需求(图 7 和图 8)。
● EMA、FDA、PMDA、Swissmedic 和 TGA 授予罕见病用药资格认定的 NAS 数量 均有所增加,从 2011~2015 年的 31% 增加至 2016~2020 年的 38%(图 5)。
● 2016~2020 年,六大监管机构批准数量 最多的前 5 个治疗领域(TA)的药物占所有批准数量的 77%。抗肿瘤药物和免疫调节剂在前 5 个 治疗领域药物中占比 49%(图 9)。
● 以 5 年为期,六大监管机构批准的产品数 量略有下降,从 2011~2015 年的 40 款 NAS 降 低至 2016~2020 年的 36 款 NAS,而过去几年 的分析数据显示数量呈增加趋势,表明制药公司 国际化的速度可能趋于平稳(图 11)。
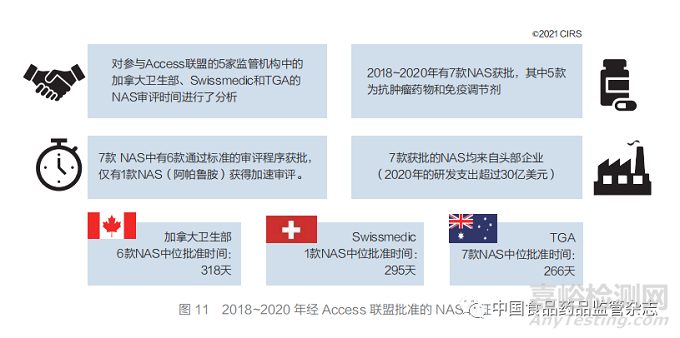
● 2018~2020 年,7 款 NAS 获 得 了 Access 联盟中一家或多家监管机构的批准(图 12)。各监管机构作为工作共享机制倡议的成员, 负责审评申报资料的不同部分。
● 2020 年,FDA、加拿大卫生部和 TGA 通过 Orbis 计划批准了 3 款 NAS(图 15),说 明监管机构进行全球合作可更快地使癌症患者获 得新疗法。
01、批准情况概述
2020 年,FDA(CDER 与 CBER) 批 准 的 NAS 数量(50)最多(图 2)。六大监管机构 在过去 10 年中批准的 NAS 数量整体有所增加, 但在过去 5 年趋于平稳,但 FDA 除外。FDA 在 2011~2020 年批准的 NAS 数量有所增加。FDA 批准的数量通常高于其他监管机构,这可能 归因于 FRP 的有效性,或 FDA 批准的一些药物, 尤其是规模较小的公司申报的药物,尚未进行国 际化运作。对 2011~2015 年和 2016~2020 年 这两个 5 年间批准的 NAS 数量进行比较后发现, Swissmedic 批准的数量差异最大,增长 29%, 其次是 FDA(18%)、EMA(10%)、加拿大卫 生部(8%)和 TGA(4%);而 PMDA 则下降 了 7%。各监管机构在批准产品数量方面存在的 差异可归因于诸多因素,如申请人根据公司自身 的规模、未满足的医疗需求和审评速度,针对不 同监管机构采取了不同的注册策略。
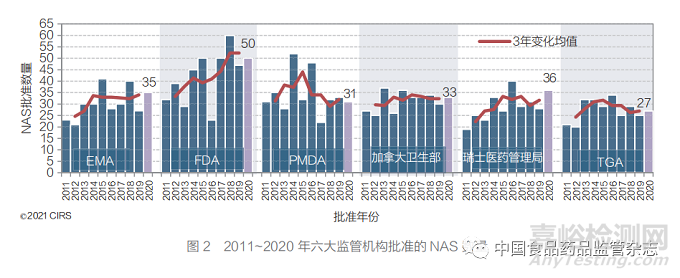
2020 年获批的新药中包括紧急授权用于 COVID-19 的瑞德西韦。未来几年的分析可能 会体现出新冠疫情对各监管机构批准 NAS 的 影响。
2020 年,FDA 中位批准时间最短(244 天), 可能归因于 FRP 的广泛应用。其次是加拿大卫 生部(306 天)、PMDA(313 天)、TGA(315 天)、 EMA(426 天)和 Swissmedic(470 天)(图 3)。尽管在过去 20 年中六大监管机构的批准时间均 趋同,但各家机构在中位批准时间方面仍存在差 异(FDA 和 Swissmedic 的批准时间相差 226天)。然而,从提交申请至科学评估结束的中位时 间之间的差异已大幅缩小(FDA 和 Swissmedic 相差 53 天)。FDA、加拿大卫生部和 TGA 的总 体批准时间和至科学评估结束的时间相同或相近, 这表明在科学评估结束后几乎没有其他相关程序。然而,对于其他监管机构而言,在科学评估结束 后仍设有其他程序,如行政程序或与申请人进行 其他谈判,如 Swissmedic 要求就标签问题进行谈判。
02、六大监管机构审评的特征
(一)审评类型
为加快具有前景的 NAS 审批进度,六大监 管机构均已设立加速审评程序(图 4)。2020年,FDA 加速审评与标准审评的 NAS 比率最高 (62%),其次是加拿大卫生部(33%)、PMDA (32%)、Swissmedic(19%) 和 EMA(9%)。TGA 自 2017 年起实施了优先审评体系;2018 年、2019 年和 2020 年分别批准了 3 项、3 项和 5 项加速审评。FDA 的加速审评比率始终居首位, 从 2011~2015 年 的 49% 增 加 至 2016~2020 年的 67%。EMA 的加速审批数量仍然最低,部 分原因是,在申请人未能满足时间线要求的情况 下,加速审评可以降格为标准审评程序。2020年, EMA 撤销了 6 款 NAS 的加速审评资格,另有 7 款 NAS 的加速审评申请请求未获批准。
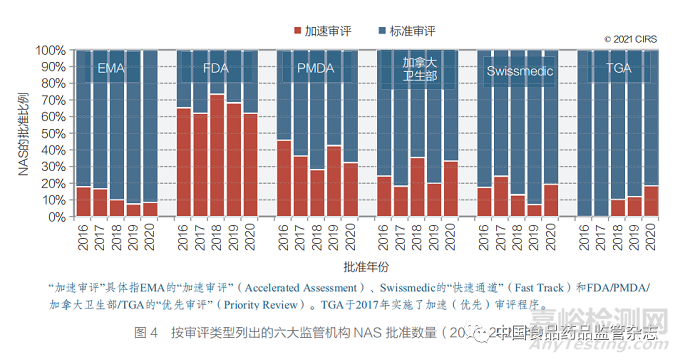
加速审评通道和其他监管促进路径的设 立和使用是解决未满足的医疗需求以及应对 其他突发公共卫生紧急事件(如 COVID-19) 的关键。
虽然 2020 年 Swissmedic 对 NAS 的标准 审评和加速审评的中位批准时间最长,但其从 提交申请到科学评估结束的标准审评中位时间 为 315 天,加速审评中位时间为 208 天,与其 他监管机构的时间相近。值得注意的是,EMA 和 Swissmedic 在科学评估结束后进行的额外 审评程序中,加速审评产品所花费的时间约为 标准审评的一半(图 5)。对于 EMA 而言,这 是由于欧盟委员会的审评速度正在加快,而对 于 Swissmedic 而言,这可能是由于针对临床 急需产品加快了标签谈判和其他行政程序的速 度。2020 年通过 TGA 优先审评流程获批的 5 款 NAS 中位获批时间为 203 天,与其他监管机构一致。

(二)罕见病用药资格认定
EMA、FDA、PMDA、Swissmedic 和 TGA 授予罕见病用药资格认定的 NAS 获批数量 均有所增加,从2011~2015 年的 31% 增加至 2016~2020年的 38%(图 6)。2016~2020年(图 6),获得罕见病用药资格认定的新药比例每年都 有所不同,但总体较高。这可能是由于疾病分层 和制药公司不断扩大研发管线,以及各监管机构 为解决未满足的医疗需求而增加的投入。2020年,FDA 和 Swissmedic 批准的罕见病用药比例最 高(62%),而 EMA 批准的罕见病用药比例最 低(19%)。各监管机构之间存在的差异可能是由 于向每个监管机构提交的产品类型以及各监管机 构对罕见病用药的认定标准不同,或申请人提交 的适应症存在差异所致。尽管加拿大卫生部并未 出台罕见病用药政策,但其 2020 年批准的 NAS 中有 58% 被 FDA、EMA 或 TGA 归为罕见病用药。
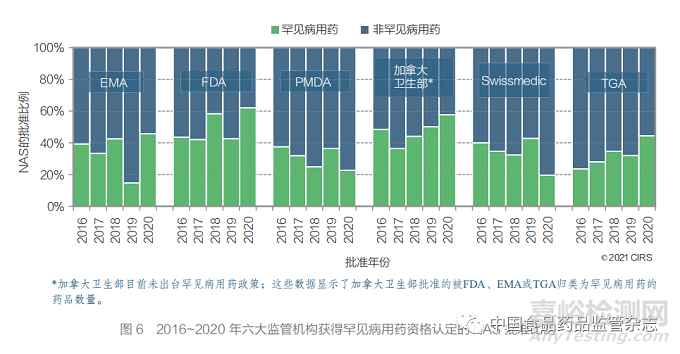
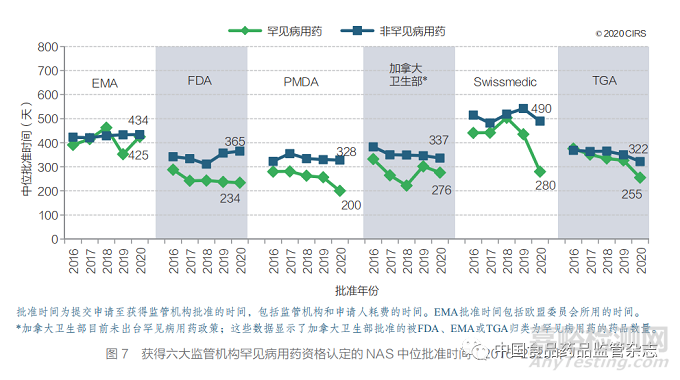
图 7 对比了 2016~2020 年六大监管机构 罕见病用药和非罕见病用药的审批时间。由于 PMDA 鼓励解决未满足的需求,日本批准的所有 罕见病用药 NAS 均获得了加速审评资格。2020 年,PMDA 罕见病用药中位批准时间最快(200天)。2020 年,FDA 罕见病用药中位批注时间 位列第二(234 天),其中 81% 的产品通过快速 审评获得批准。加拿大卫生部目前未出台罕见病 用药政策;但被 FDA、EMA 或 TGA 归类为罕 见病用药的 19 款 NAS 在 2020 年获得加拿大 卫生部批准,中位批准时间为 276 天。2020 年 EMA 批准的 16 款罕见病用药的中位时间为 425 天,其中 3 款 NAS(19%)获得该监管机构的 快速审评。2020 年 TGA 批准的罕见病用药中有 33% 通过优先审评程序获批,其中位批准时间比 非罕见病用药缩短了 67 天。
(三)加速审评路径(FRP)
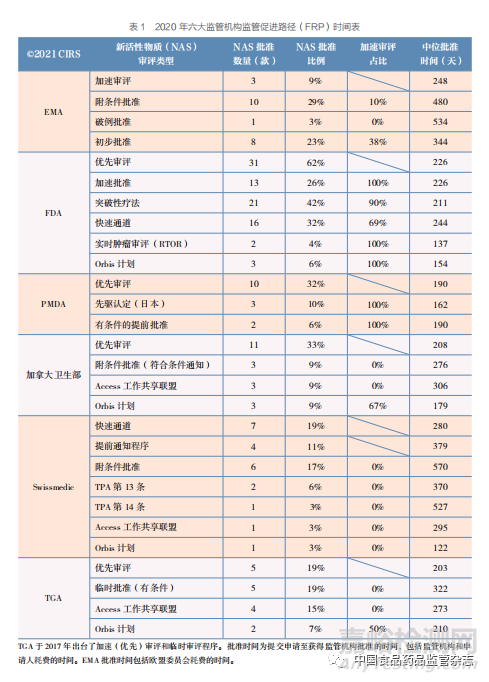
在六大监管机构中,FDA 通过 FRP 批准的 NAS 数量最多,以加速药物的审评、审批和上 市,解决未满足的需求(图 8 和表 1)。
六大监管机构批准瑞德西韦的时间为 3~148 天不等。为快速审批瑞德西韦,六大监 管机构采用了多种加速审评通道和其他 FRP, 如附条件批准、FDA 快速审评通道和滚动审 评(如 EMA 和 FDA)
(四)治疗领域
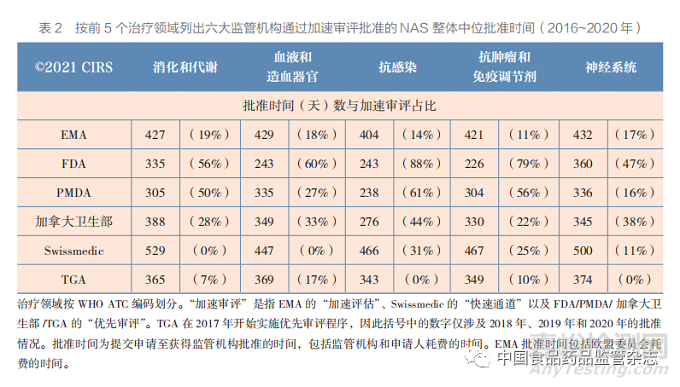
2016~2020 年, 六 大 监 管 机 构 批 准 药 物 数量前 5 的治疗领域占所有批准数量的 77% (790/1023),其中抗肿瘤和免疫调节剂品种 占前 5 个治疗领域批准数量的 49%(385 款, 图 9)。抗感染治疗药物 NAS 的批准速度略快, 其总体中位批准时间为 296 天,而抗肿瘤和免疫 调节剂 NAS 为 340 天,血液和造血器官 NAS 为 357 天,神经系统 NAS 为 365 天,消化和 代 谢 NAS 为 365 天。在 前 5 大 治 疗 领 域 中, PMDA 对 3 个领域 NAS 的批准速度最快,而 FDA 对抗肿瘤和免疫调节剂以及血液和造血器官 NAS 的批准速度最快。但是,如 25%~75% 区 间值条形图所示,各监管机构在不同治疗领域的 批准时间也有较大差异。这可能反映了各监管机 构对于这 5 个治疗领域的药物使用快速审评通道 的频率更高(表 2)。
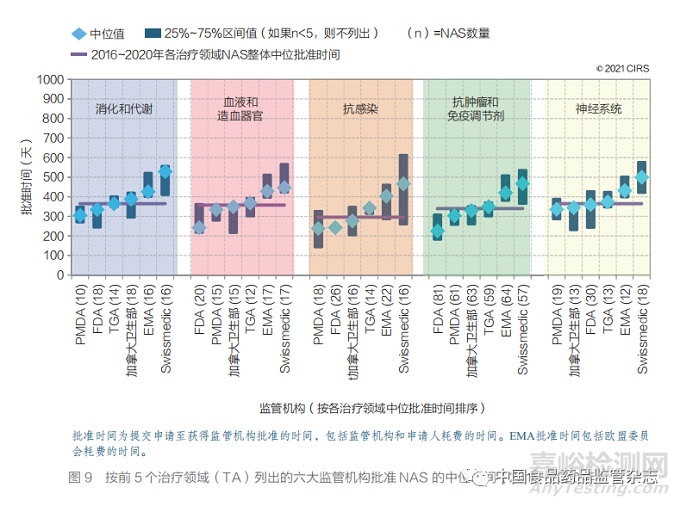
瑞德西韦是六大监管机构批准最快的抗 感染药物之一。未来几年的分析可能会显示 COVID-19 对各监管机构对于其他治疗领域药 物批准时间的影响。
03、监管机构共同批准的情况
(一)六大监管机构共同批准的情况
通过对六大监管机构已批准药物审评情况 的研究,对比各监管机构的工作绩效。本文将过 去 10 年分为两个时间段(即 2011~2015 年和 2016~2020 年),以确定是否能识别出任何变化趋势。六大监管机构在两个 5 年中批准的产品数 量 略 有 下 降, 从 2011~2015 年 40 款 NAS 降 至 2016~2020 年 36 款 NAS, 但 在 过 去 几 年 的分析中这一数据呈增加趋势,表明制药公司国 际化速度可能趋于平稳。注册总时间,包括提交 时间差和批准时间(图 10),可能是由一系列影 响 NAS 获批的潜在因素共同决定的。这些影响 因素可能包括制药公司的申报策略以及各监管机 构为解决未满足的医疗需求而对具有前景的药物 采用快速通道进行审评的情况。本研究发现,企 业向监管机构提交申请的顺序未发生变化,即首 先提交给 EMA 和 FDA,然后提交给加拿大卫生 部、Swissmedic 和 TGA,最后提交给 PMDA。FDA 审批时间最短,因为药企最先向 FDA 申报, 并且 FDA 的监管审评速度较快。EMA 几乎和 FDA 同步收到申请人提交的申报资料,在对两 个 5 年时间段进行比较后发现,EMA 和 FDA 产 品批准整体时间均有所缩短。在这两个时间段内, 申请人向加拿大卫生部和 TGA 提交申请的时间 差大体保持不变,而 Swissmedic 的提交时间差 略有增加。但是对于 PMDA 而言,这两个 5 年 时间段的提交时间差缩短了 176 天。从申请人向 第一家监管机构首次提交申请至获批的总体时间 来看,两个 5 年时间段之间的差异表明,PMDA 的总体时间有所缩短,而 EMA、FDA、加拿大 卫生部、TGA 和 Swissmedic 在这两个时间段之间的总体时间差异很小。
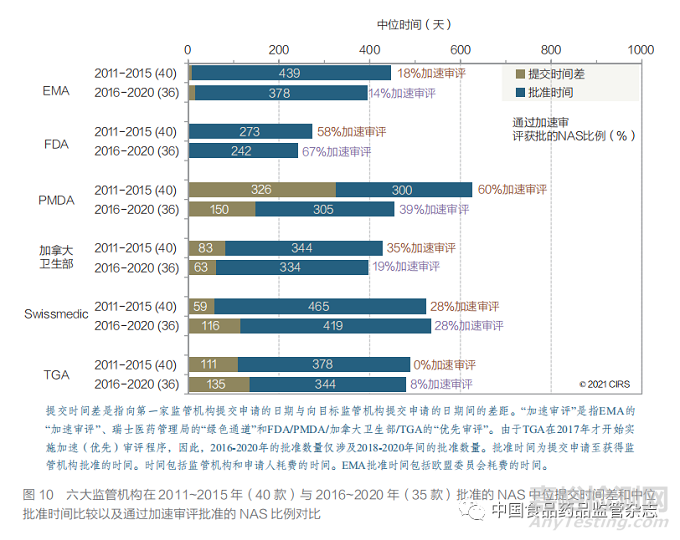
COVID-19 可能对未来几年药品的国际化 产生影响。
(二)Access 工作共享联盟
Access 联 盟 是 一 个 中 等 规 模 的 联 合 体, 2007 年由“志同道合”的监管机构共同成立, 旨在促进更多监管合作和提升监管一致性。其成 员包括澳大利亚、加拿大、新加坡、瑞士,英国 于 2020 年 10 月加入。该联盟的目标是最大限 度地开展国际合作,减少重复性的审评,以及增 强各监管机构的能力,确保患者及时获得高质量、 安全和有效的治疗产品。各监管机构作为该共享 联盟的成员,负责审评申报资料的不同部分。尽 管各监管机构之间共享审评结果,但每家监管机 构均独立作出是否批准新药上市的决定。目前这 种“共享”模式正受到广泛关注和评估,以确定 其能否成为其他“志同道合”的监管机构在区域 内或跨区域共享资源、并简化与企业之间互动的 模板。
图 11 对 加 拿 大 卫 生 部、Swissmedic 和 TGA通过新化学实体工作共享倡议于 2018~2020 年批准 NAS 的数据进行了分析,其中 7 款 NAS 获得了一家或多家监管机构的批准(图 11)。2018~2019 年加拿大卫生部和 TGA 合作批准 了 3 款 NAS,自 2020 年以来,Swissmedic 和 新加坡健康科学管理局(HSA)也加入了该合作 机制(图 12)。在中位批准时间方面存在的差异 可归因于 2018~2019 年该倡议仍处于探索阶段;通过这一倡议,TGA 和加拿大卫生部对收到的相 同申报材料进行回顾,以识别候选药物。之后, 该程序正式启动,并且要求申请人在其拟定的申 请日期前 3~6 个月先提交意向书。申请人应同时 将申请提交给该联盟的各监管机构,时间差最好 在 15 日内。未来可能不会出现提交时间差的问 题,但由于监管机构审评流程存在差异,对部分 审评仍可能存在差异,例如 TGA 要求预先提交注册计划表格。

(三)Orbis 计划
Orbis 计 划 是 美 国 FDA 肿 瘤 卓 越 中 心 (Oncology Center of Excellence,OCE) 发 起的一项倡议计划,为国际药品监管合作机构间肿瘤产品的同步提交和审评提供了合作框架。在 那些监管提交可能存在明显延迟的国家中,该计 划可使肿瘤患者更早地获得治疗产品,无论这些 产品是否已获得 FDA 批准。通过这一同步提交 申报资料和审评肿瘤治疗药物的框架,Orbis 计 划有利于通过联合审评机制识别各审评团队之间 的监管差异。该计划由 FDA 协调,与 Access 联盟类似,成员包括 TGA、加拿大卫生部、药 品和健康产品管理局(MHRA)、新加坡卫生科 学 局(has)、Swissmedic, 以 及 巴 西 国 家 卫 生监督局(ANVISA),ANVISA 目前尚未加入 Access 联盟。
2020 年,FDA、加拿大卫生部和 TGA 通过 Orbis 计划批准了 3 款 NAS(图 13)。第一款 NAS 是 FDA、Swissmedic 和加拿大卫生部合 作批准的,而另外两款则是 FDA、加拿大卫生部 和 TGA 合作批准的。值得注意的是,不同 NAS 在罕见病用药资格认定以及所采用的审评类型(加 速审评和标准审评)方面存在差异,这反映出各 监管机构有关加速审评或罕见病用药资格认定的 标准、可采用的审评流程(加拿大卫生部目前尚 未实施罕见病用药政策)以及药企为申请加速通 道或资格认定而采取的申报策略方面存在的差异。Orbis 计划已证明,全球范围内的监管机构进行 合作是现实可行的,并且可以更快地为肿瘤患者 提供新疗法。此外,该计划可以在更大范围内促 进治疗方法的开发,尤其是在全球合作对公共健 康至关重要的领域,比如目前的 COVID-19 大 流行。
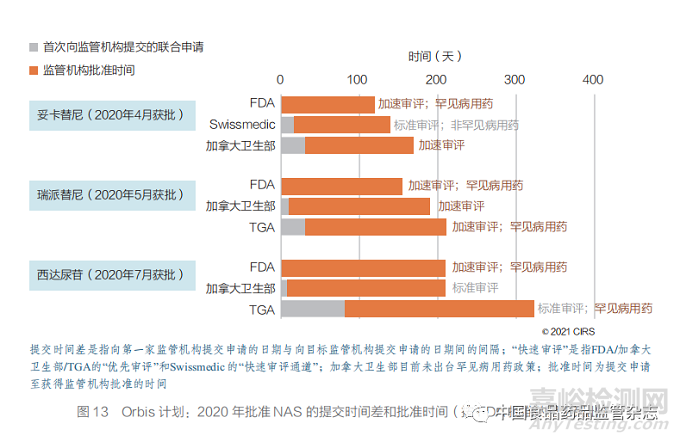
04、2020 年六大监管机构批准 NAS 汇总
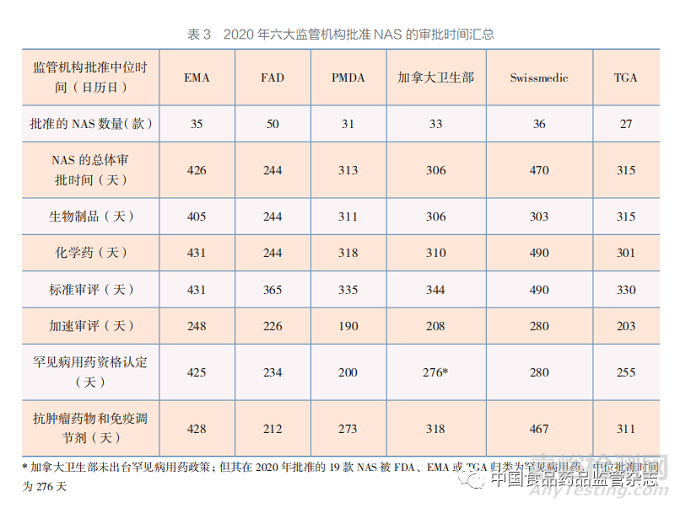
表 3 按产品类型、审评类型和主要治疗领域, 对六大监管机构在 2020 年批准 NAS 的审批时间进行了汇总。
05、2020 年六大监管机构 NAS 审批 特点
(一)EMA 审批特点
1. EMA 2020 年批准的 NAS
EMA 在 2020 年共批准 35 款 NAS,中位 批准时间为 426 天(至科学评估结束的时间为 370 天)。其中,欧盟委员会的中位批准时间为 57 天,EMA 审评时间为 240 天,制药公司花费 时间为 128 天。
2. 获批药物类型
2020 年,EMA 批准 11 款生物制品 NAS, 中 位 批 准 时 间 为 405 天;批 准 24 款 化 学 药 NAS,中位批准时间为 431 天;批准 13 款抗肿 瘤药物和免疫调节剂 NAS,中位批准时间为 428 天;批准 22 款其他治疗领域 NAS,中位批准时 间为 426 天。
3. 资格认定和审评类型
2020 年,EMA 通过加速审评批准 2 款 NAS, 中位批准时间为 248 天,比 2020 年通过标准审评 获批的 32 款 NAS 的中位批准时间缩短 183 天。
2020 年,EMA 批 准 16 款 罕 见 病 用 药 NAS,中位批准时间为 425 天,比 2020 年 19 款非罕见病用药 NAS 的中位批准时间缩短了 9 天。
4. 药物获批时间
2020 年 EMA 批准的 NAS 中,有 23% 最 先获得 EMA 批准,或是在 FDA、PMDA、加拿 大卫生部、Swissmedic 或 TGA 首次批准后 1 个月内获得 EMA 批准。
另外 77% 的 NAS 最先获得 FDA、PMDA、 加拿大卫生部、Swissmedic 或 TGA 批准,或 是在这五家监管机构批准 1 个月后获得 EMA 批 准;这些 NAS 提交至 EMA 的中位提交时间差 为 24 天。
(二)FDA 审批特点
1. FDA 2020 年批准的 NAS
2020 年,FDA(CDER 和 CBER)共批准 50 款 NAS,中位批准时间为 244 天。
FDA 批准的 NAS 中有 94% 为首轮批准, 6% 为二轮批准。
2. 获批药物类型
2020 年,FDA 批准 15 款生物制品 NAS, 中 位 批 准 时 间 为 244 天;批 准 35 款 化 学 药 NAS,中位批准时间为 244 天;批准 22 款抗肿 瘤药物和免疫调节剂 NAS,中位批准时间为 212 天;批准 28 款其他治疗领域 NAS,中位批准时 间为 327 天。
3. 资格认定和审评类型
2020 年,FDA 通 过 加 速 审 评 批 准 31 款 NAS,中位批准时间为 226 天,比 2020 年 19 款标准审评 NAS 的中位批准时间缩短 139 天。
2020 年,FDA 批 准 31 款 罕 见 病 用 药 NAS,中位批准时间为 234 天,比 2020 年 19 款非罕见病用药 NAS 的中位批准时间缩短了 131 天。
4. 药物获批时间
2020 年 FDA 批准的 NAS 中,86% 最先获 得 FDA 批准,或是在 EMA、PMDA、加拿大卫 生部、Swissmedic 或 TGA 首次批准后的 1 个 月内获得 FDA 批准。
另外 14% 的 NAS 最先获得 EMA、PMDA、 加拿大卫生部、Swissmedic 或 TGA 批准,或是在这五家监管机构批准 1 个月后才获得 FDA 批准;这些 NAS 提交至 FDA 的中位提交时间差 为 118 天。
(三)PMDA 审批特点
1. PMDA 2020 年批准的 NAS
2020 年,PMDA 共批准 31 款 NAS,中位 批准时间为 313 天(至科学评估结束的时间为 272 天)。
2. 获批药物类型
2020 年,PMDA 批准 5 款生物制品 NAS, 中 位 批 准 时 间 为 311 天;批 准 26 款 化 学 药 NAS,中位批准时间为 318 天;批准 14 款抗肿 瘤药物和免疫调节剂 NAS,中位批准时间为 273 天;批准 17 款其他治疗领域 NAS,中位批准时 间为 322 天。
3. 资格认定和审评类型
2020 年,PMDA 通过加速审评批准 10 款 NAS,中位批准时间为 190 天,比 2020 年 21 款标准审评 NAS 的中位批准时间缩短 145 天。
2020 年,PMDA 批 准 7 款 罕 见 病 用 药 NAS,中位批准时间为 200 天,比 2020 年 24 款非罕见病用药 NAS 的中位批准时间缩短了 128 天。
4. 药物获批时间
2020 年 PMDA 批准的 NAS 中,45% 最先 获得 PMDA 批准,或是在 EMA、FDA、加拿大 卫生部、Swissmedic 或 TGA 首次批准后的 1 个月内获得 PMDA 批准。
另外 55% 的 NAS 最先获得 EMA、FDA、 加拿大卫生部、Swissmedic 或 TGA 批准,或 是在这五家监管机构批准 1 个月后才获得 PMDA 批准;这些 NAS 提交至 PMDA 的中位提交时间 差为 689 天。
(四)加拿大卫生部审批特点
1. 加拿大卫生部 2020 年批准的 NAS
2020 年,加拿大卫生部共批准 33 款 NAS, 中位批准时间为 306 天(至科学评估结束的时间 为 305 天)。
2. 获批药物类型
2020 年,加拿大卫生部批准 11 款生物制品 NAS,中位批准时间为 306 天;批准 22 款化学 药 NAS,中位批准时间为 310 天;批准 14 款 抗肿瘤药物和免疫调节剂 NAS,中位批准时间为 318 天;批准 19 款其他治疗领域 NAS,中位批 准时间为 295 天。
3. 资格认定和审评类型
2020 年,加拿大卫生部通过加速审评批准 11 款 NAS,中位批准时间为 208 天,比 2020 年 22 款标准审评 NAS 的中位批准时间缩短 136 天。
加拿大卫生部未出台罕见病用药政策,但 2020 年加拿大卫生部批准的 15 款 NAS 被 FDA、 EMA 或 TGA 归类为罕见病用药,中位批准时间 为 276 天。
4. 药物获批时间
2020 年加拿大卫生部批准的 NAS 中,9% 最 先 获 得 加 拿 大 卫 生 部 批 准, 或 是 在 EMA、 FDA、PMDA、Swissmedic 或 TGA 首次批准 后的 1 个月内获得加拿大卫生部批准。
另外 91% 的 NAS 最先获得 EMA、FDA、 PMDA、Swissmedic 或 TGA 批准,或是在这 五家监管机构批准 1 个月后才获得加拿大卫生部 批准;这些 NAS 提交至加拿大卫生部的中位提 交时间差为 307 天。
(五)Swissmedic 审批特点
1. Swissmedic 2020 年批准的 NAS
2020 年,Swissmedic 共批准 36 款 NAS, 中位批准时间为 470 天(至科学评估结束的时间 为 297 天)。
2. 获批药物类型
2020 年,Swissmedic 批准 10 款生物制品 NAS,中位批准时间为 303 天;批准 26 款化学 药 NAS,中位批准时间为 490 天;批准 17 款 抗肿瘤药物和免疫调节剂 NAS,中位批准时间为 467 天;批准 19 款其他治疗领域 NAS,中位批 准时间为 472 天。
3. 资格认定和审评类型
2020 年,Swissmedic 通过加速审评批准 7 款 NAS,中位批准时间为 280 天,比 2020 年 29 款标准审评 NAS 的中位批准时间缩短 210 天。
2020 年,Swissmedic 批准 7 款罕见病用 药 NAS,中位批准时间为 280 天,比 2020 年 29 款非罕见病用药 NAS 的中位批准时间缩短 210 天。
4. 药物获批时间
2020 年 Swissmedic 批准的 NAS 中,8% 最 先 获 得 Swissmedic 批 准, 或 是 在 FDA、 EMA、PMDA、加拿大卫生部或 TGA 批准 1 个 月内获得 Swissmedic 批准。
另外 92% 的 NAS 最先获得 FDA、EMA、 PMDA、加拿大卫生部或 TGA 批准,或是在这 五家监管机构批准 1 个月后才获得 Swissmedic 批准;这些 NAS 提交至 Swissmedic 的中位提 交时间差为 270 天。
(六)TGA 审批特点
1. TGA 2020 年批准的 NAS
2020 年,TGA 共批准 27 款 NAS,中位批 准时间为 315 天。
2. 获批药物类型
2020 年,TGA 批 准 5 款 生 物 制 品 NAS, 中 位 批 准 时 间 为 315 天;批 准 22 款 化 学 药 NAS,中位批准时间为 301 天;批准 16 款抗肿 瘤药物和免疫调节剂 NAS,中位批准时间为 311 天;批准 11 款其他治疗领域 NAS,中位批准时 间为 315 天。
3. 资格认定和审评类型
2020 年,TGA 通 过 加 速 审 评 批 准 5 款 NAS,中位批准时间为 203 天,比 2020 年 22 款标准审评 NAS 的中位批准时间缩短 127 天。
2020 年,TGA 批 准 12 款 罕 见 病 用 药 NAS,中位批准时间为 255 天,比 2020 年 15 款非罕见病用药 NAS的中位批准时间缩短 67天。
4. 药物获批时间
2020 年 TGA 批准的 NAS 中,4% 最先获 得 TGA 批 准, 或 是 在 FDA、EMA、PMDA、 加拿大卫生部或 Swissmedic 批准 1 个月内获得 TGA 批准。
另外 96% 的 NAS 最先获得 FDA、EMA、 PMDA、加拿大卫生部或 Swissmedic 批准,或 是在这五家监管机构批准 1 个月后才获得 TGA 批准;这些 NAS 提交至 TGA 的中位提交时间差 为 484 天。

来源:中国食品药品监管杂志


