您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-16 21:37
一、低温保存箱的结构与工作原理
1.低温保存箱的结构
医用低温保存箱按门或盖的打开形式可分为顶开式(卧式)和直立式(立式)。
医用低温保存箱一般由围护结构、制冷系统、控制系统、数据记录系统(可选配)及相关附件组成。不同生产企业的产品,在结构上存在一定差异,可不完全与本部分描述一致。
(1)围护结构用于医用低温保存箱的存储空间结构的组成及保温。
(2)制冷系统用于实现热量的转移,使存储空间内维持所需求的温度环境。
(3)控制系统(可包括相应软件及独立电源部分等)用于温度等参数的监控及供电。
(4)数据记录系统(可选配)用于箱内温度或存储样品信息等的记录,包括打印机、温度记录仪、电子存储设备等。
(5)附件一般包括容器和搁架,也包括需用人工取出的盛物盘等。
2.低温保存箱的工作原理
产品以消耗电能的手段实现热量的转移,从而主动制造出所需的低温环境。
蒸汽压缩式制冷是指液态制冷剂在蒸发器中汽化变成气态制冷剂进入压缩机,被压缩成高温高压的气体,然后排放到冷凝器中,在冷凝器的作用下,气态制冷剂被冷却成高压的液体,然后进入节流装置(常见的有毛细管和膨胀阀),被节流的液态制冷剂的压力和温度再次降低,液态制冷剂进入蒸发器后,会再次汽化吸热,周而复始达到制冷效果。
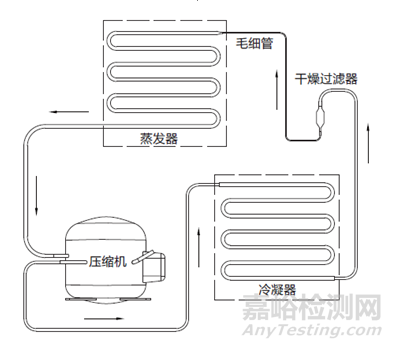
图1 工作原理示意图
二、低温保存箱的研发实验要求
1.产品性能研究
应当进行产品性能研究以及产品技术要求的研究和编制说明,包括功能性、安全性指标(如电气安全与电磁兼容)以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
研究资料中,需对医用低温保存箱产品所采用的制冷原理进行详细描述,写明制冷原理类型,如单级制冷系统、双级或多级复叠制冷系统,应列明工作原理框图,并给出详细的解释说明。需要对制冷系统所使用的制冷剂组分进行描述,应列明制冷剂制冷循环图、压焓图,并给出详细的解释说明。应对预期冷冻的样本进行相应的描述及验证。
2.消毒工艺研究
应当明确推荐的消毒工艺(方法和参数)以及所推荐消毒方法的确定依据及必要的验证资料。
3.产品有效期和包装研究
因各生产企业采用的原材料不同,同时考虑到使用频次的不同及一些不可预期的因素,产品的实际有效期会不同。应对产品有效期进行研究验证。
产品经环境试验和模拟运输试验验证,包装应符合运输和贮存的要求。
4.软件研究
参见《医疗器械软件注册技术审查指导原则》(国家食品药品监督管理总局通告2015年第50号)的相关要求。
对于具有网络连接功能以进行电子数据交换或远程监测的产品,还应当按照《医疗器械网络安全注册技术审查指导原则》(国家食品药品监督管理总局通告2017年第13号)单独出具一份网络安全描述文档。
5.主要性能指标
5.1.规格型号
医用低温保存箱可按预期用途、结构组成、总有效容积、特性点温度等分为不同规格型号,可参照GB/T 20154—2014的规定,如:DW—86L370表示—86℃、立式、总有效容积为370L的低温保存箱。
5.2.软件信息
需对软件名称、型号规格、发布版本、完整版本命名规则作出规定。
5.3.一般性能
应符合GB/T 20154—2014的技术要求。
应对附件制定相应要求,如容器、搁架、需用人工取出的盛物盘、温度传感器等。
软件功能应符合说明书及软件描述文档中的功能描述。
若产品具有用以进行电子数据交换或远程监测的网络连接功能,应制定相应要求。
超出本指导原则温度范围的医用低温保存箱可参考上述条款制定性能要求。
5.4.安全性能
应符合GB 4793.1—2007的要求,并以附录形式列明医用实验室用电气设备基本安全特征(无需编写详细的电气安全附录)。如需编写详细的电气安全附录,建议注明适用项目及不适用项目理由。
5.5.电磁兼容
应符合GB/T 18268.1—2010的要求。
6.环境试验
应符合GB/T 14710—2009的要求。
应逐项审查上述要求和检验结果是否符合规定。
三、相关标准
目前与产品相关的国家标准、行业标准列举如下:
表1 相关产品标准
|
GB/T 191—2008 |
包装储运图示标志 |
|
GB 4706.13—2014 |
家用和类似用途电器的安全 制冷器具冰淇淋机和制冰机的特殊要求 |
|
GB 4793.1—2007 |
测量、控制和实验室用电气设备的安全要求 第1部分:通用要求 |
|
GB/T 14710—2009 |
医用电器环境要求及试验方法 |
|
GB/T 18268.1—2010 |
测量、控制和实验室用的电设备 电磁兼容性要求 第1部分:通用要求 |
|
GB/T 20154—2014 |
低温保存箱 |
|
YY/T 0316—2016 |
医疗器械 风险管理对医疗器械的应用 |
|
YY 0466.1—2016 |
医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求 |
四、主要风险
医用低温保存箱的风险分析资料应符合YY/T 0316—2016《医疗器械 风险管理对医疗器械的应用》的有关要求。
表2 产品主要危险(源)、可预见的事件序列和可能发生的伤害之间的关系
|
危险(源) |
可预见的事件序列 |
伤害 |
|
电能 |
保护接地阻抗、可触及部分的接触电压、电介质强度不符合要求; 机器外壳的防护罩封闭不良;不适当的供电电压;电磁兼容性能不符合要求。 |
严重时导致操作人员触电死亡; 影响其他设备的正常运转,导致人体伤害。 |
|
热能 |
操作人员不戴手套到箱内存放或取出样品。 |
可能造成操作人员冻伤。 |
|
机械 |
设备外壳粗糙、有毛刺;设备没有足够的外壳机械强度和刚度;机械稳定性不够。 |
导致操作人员碰伤、挤伤、划伤等伤害。 |
|
噪声 |
系统管路互碰或运动部件损坏;压缩机噪声。 |
噪声污染。 |
|
化学物质 |
使用不适当的保温材料;蓄电池达到寿命随意丢弃。 |
污染环境。 |
|
功能 |
制冷剂泄露、密封不良;软件失效;实际储存温度与显示板温度不符、故障提示异常。 |
产品达不到预期使用温度,保存的产品失效。 |
|
人为因素 |
操作人员使用不当;软件被误操作、长时间打开门或盖以及忘记关门或盖。 |
保存产品的质量受到影响。 |
|
随机信息 |
外部和内部标记不全面、标记不正确或不能够清楚易认,标记位置不恰当,以及标记不能够永久贴牢;说明书缺少必要的警告说明和详细的使用方法;缺少详细的日常使用维护规范;说明书中有关维护、保养等内容不明确。如:预防性检查、保养以及保养周期等;对设备的使用寿命或终止使用的条件没有明确规定。 |
保存产品的质量受到影响。 |

来源:嘉峪检测网


