您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-31 10:37
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
科济CT053北美上关键II期临床。科济药业自主研发的全人源抗BCMA CAR-T(CT053)用于治疗复发╱难治多发性骨髓瘤的北美关键II期试验已完成首例受试者入组及给药。CT053具有独特的CAR结构,兼具免疫原性低与稳定性高的优点。在I期临床中,没有出现3级或以上的CRS及治疗相关死亡,表明CT053具有良好的安全性。CT053于2019年获FDA授予再生医学高级疗法与孤儿药资格,亦于2020年被国家药监局纳入突破性治疗品种。
国内药讯
1.誉衡药业/药明生物PD-1获批上市。誉衡药业与药明生物联合开发的PD-1抗体赛帕利单抗(GLS-010)获NMPA批准上市,用于治疗二线以上复发或难治性经典型霍奇金淋巴瘤患者。在一项II期(NCT03655483)试验中,中位随访6.57个月时,IRC评估的客观缓解率为91.76%,其中30 例(35.3%)患者达到完全缓解,48例(56.5%)达到部分缓解。这是NMPA批准的第6款国产PD-1单抗。
2.微芯JAK3抑制剂在美获批临床。微芯生物JAK1/TBK1双效抑制剂CS12192用于治疗移植物抗宿主病(GVHD)的新药临床试验申请获FDA批准。临床前研究表明,CS12192在类风湿性关节炎、多发性硬化病、系统红斑狼疮、银屑病等自身免疫性疾病模型及移植物抗宿主病模型上均具有明显的药效活性。在国内,CS12192胶囊已完成一项用于类风湿性关节炎适应症的Ⅰ期临床。
3.南京维立志博LBL-007报IND。南京维立志博生物自主研发的LBL-007注射液的临床试验申请获CDE受理。LBL-007是一款IgG4亚型全人源单克隆抗体,能特异性地结合LAG-3蛋白,从而阻断LAG-3蛋白与其配体的结合,进而恢复T细胞的免疫功能。前期的药效表明LBL-007具有良好抑制肿瘤的功能活性,已于2019年8月获批开展晚期实体瘤及淋巴瘤的I期临床试验,并于2020年3月获FDA批准临床。
4.康方与辉瑞合作开发双抗联合疗法。康方生物PD-1/CTLA-4双抗Cadonilimab(AK104)将联合辉瑞阿昔替尼(商品名:英立达)开展联合用药研究,评估用于晚期/转移性透明细胞肾细胞癌(ccRCC)一线治疗的有效性和安全性。AK104是康方全球首创的新型、潜在下一代双特异性肿瘤免疫治疗骨干药物,已在临床中显示出与PD-1单抗单药,或PD-1单抗联合CTLA-4单抗的联合疗法相比,具有明显的疗效以及安全性优势。
5.正大天晴引进亿一生物长效升白药。亿帆医药子公司亿一生物与正大天晴旗下顺欣制药达成一项独家合作协议,顺欣制药将获得用于治疗中性粒细胞减少症(CIN)的长效G-CSF艾贝格司亭α在中国市场的独家商业化授权。根据协议,亿一生物将获最高可达2.1亿元的首付款与里程碑付款,以及产品销售额提成。艾贝格司亭α在中国大陆进一步开发的责任和费用由两家公司共同承担。
国际药讯
1.FDA发文指导PD-1替代给药方案。FDA于8月25日发布《支持PD-1或PD-L1阻断抗体用于治疗癌症患者的替代给药方案的基于药代动力学的标准》指南草案。新指南草案指出一种基于群体药代动力学(pop-PK)模型的方法,以支持已批准的PD-1或PD-L1抗体的替代给药方案。申办人应确保替代给药方案申请使用用于在临床中证明有效性的方案作为参照给药方案。在PK方面,与参照方案相比,曲线下平均面积和血清谷浓度不应下降超过20%。
2.治疗中风医疗器械获FDA批准上市。FDA批准MicroTransponder公司开发的Vivistim Paired VNS System(Vivistim System)康复系统,以治疗中风患者。这是一款不基于药物的康复系统,旨在利用迷走神经电刺激(VNS)治疗与慢性缺血性中风相关的中/重度上肢运动缺陷。Vivistim系统曾被授予突破性医疗器械认定。Vivistim系统是一种处方医疗器械,可在诊所和家庭中使用。
3.FcRn拮抗剂在欧盟报NDA。欧洲药品管理局(EMA)受理argenx公司FcRn拮抗剂efgartigimod的上市申请,用于治疗全身型重症肌无力(gMG),预计明年年中作出审查决定。在关键Ⅲ期ADAPT试验中,与安慰剂组相比,efgartigimod治疗组在MG-ADL评分上连续4周或更长时间至少有2分改善的患者比例更高(67.7%vs29.7%;p<0.0001)。如果获批,efgartigimod将成为首个获得监管批准的FcRn拮抗剂。再鼎医药拥有该新药在大中华区独家权利。
4.巴替利单抗治疗宫颈癌Ⅱ期临床积极。Agenus公司PD-1单抗巴替利单抗(balstilimab)治疗复发/转移性宫颈癌的Ⅱ期临床成果发表在Gynecologic Oncology上。试验结果显示,balstilimab在PD-L1阳性肿瘤患者中的客观缓解率(ORR)为20.0%;中位随访14.6个月时,中位缓解持续时间(DoR)尚未达到。在经确认的PD-L1阳性或阴性肿瘤患者的ORR为15.0%;中位DoR为15.4个月,疾病控制率约为50%。
5.拜耳创新MRA拮抗剂Ⅲ期临床结果发布。拜耳(Bayer)公司非甾体选择性MRA拮抗剂Kerendia(finerenone)治疗伴有慢性肾病(CKD)的2型糖尿病(T2D)患者的Ⅲ期临床FIGARO-DKD达到主要终点。在已接受最大耐受剂量血管紧张素转换酶抑制剂(ACEi)或血管紧张素受体阻滞剂(ARB)的情况下,使用Kerendia将患者首次出现心血管死亡或非致死心血管事件的风险降低13%(HR=0.87, 95% CI,0.76-0.98, p=0.0264)。详细结果在《新英格兰医学杂志》上发布。
6.新型溶瘤病毒治疗胰腺癌临床前研究积极。TILT Biotherapeutics公司表达IL-2变体的5/3血清型嵌合腺病毒免疫疗法TILT-452(Ad5/3-E2F-d24-vIL2)临床前研究结果积极。在胰腺癌仓鼠模型中,TILT-452显著缩小肿瘤体积,而且在实验结束时(160天后),62.5%的动物仍然存活,而未接受治疗的动物都在82天内死亡。同时,组织学研究显示TILT-452能够改变肿瘤微环境。
医药热点
1.上海出台新冠肺炎中医药预防方案。上海市新冠肺炎医疗救治组29日披露,上海推动中医药纳入“四早”(早发现、早报告、早隔离、早治疗)新冠肺炎防控体系,应对德尔塔毒株,制定推广了上海市新冠肺炎中医药预防方案,同时明晰普通人群、重点人群、体弱人群和儿童人群的防治策略,以此提升综合预防效果。
2.重点人群可接种新冠疫苗“加强针”。在8月27日国务院联防联控机制召开的新闻发布会上,针对接种新冠疫苗6个月后是否需要增打“加强针”的热点问题,国务院联防联控机制科研攻关组疫苗研发专班工作组组长郑忠伟表示,海关、边检、航空、隔离点防疫、定点医疗机构等的工作人员可开展新冠疫苗加强免疫;但是否需对全人群进行加强免疫,还有待进一步研究。
3.49%新冠康复者一年后仍存持续症状。2021年8月27日,中日友好医院国家呼吸内科中心曹斌教授联合首都医科大学等研究人员在《柳叶刀》"The Lancet"上发表的最新研究论文显示,无论最初的COVID-19疾病的严重程度如何,许多症状都会随着时间的推移而消失。一年后仍出现至少一种症状的患者比例从六个月时的68%下降到12个月时的49%。疲劳或肌肉无力是最常见的症状。
4.君实/礼来新冠鸡尾酒疗法恢复分发。礼来27日宣布,FDA已恢复其与君实合作的新冠鸡尾酒疗法bamlanivimab/etesevimab的分发。此前在体外分析试验中,由于该组合疗显示对巴西突变株(P.1)与南非突变株(B.1.351)没有中和活性,被美国公卫卫生与服务部(HHS)于6月25日停止分发。与君实合作的新冠中和抗体在2020年为礼来带来8.71亿美元的收入,在2021 Q1和2021 Q2分别带来8.1亿美元和1.49亿美元的收入。
评审动态
申请临床:
重庆文理学院的PZ-1片(2个规格)、江苏康润生的四价流感病毒裂解疫苗(2个规格)、同润生物的注射用CN202、明治制果药业株式会社/杭州倍嘉医药的替比培南匹酯细粒剂、乐普生物的CG0070注射液。
申请生产:
齐鲁制药的地舒单抗注射液、深圳市罗素医药的贝美前列素滴眼液、 武汉用通医药的苯磺酸阿曲库铵注射液(2个规格)。
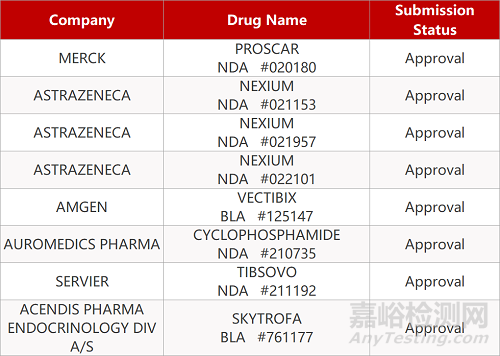
2. FDA新药获批情况(北美08月25日)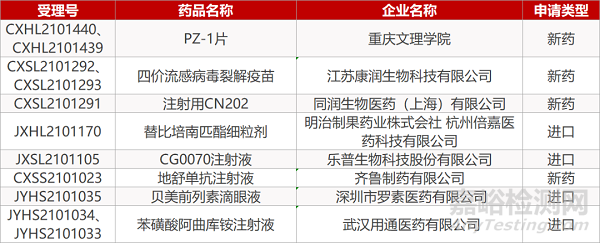

来源:药研发


