您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2021-07-01 20:23
无菌工艺
无菌生产(Aseptic Processing) 是指以防止污染为目的,在无菌系统环境下,通过除菌过滤法或无菌生产工艺,消除导致污染的各种可能性来保证无菌水平。按照去除微生物的时机和方法不同,无菌生产工艺可以分为最终灭菌工艺和非最终灭菌。采用最终灭菌生产工艺一般为大容量注射剂,其灌装和配制过程可在非无菌环境中生产,在产品灌装完成后,最终需通过灭菌措施来达到无菌的要求。而无菌生产工艺一般适宜于粉针剂,亦可适宜于临床需要,但不能进行终端灭菌的小容量注射剂。一般是不耐热且不能成品灭菌的药品。所以必须强调生产过程的无菌操作。
无菌生产工艺和最终灭菌工艺具有不同的系统要求,不同的除菌方法会有不同的无菌保证结果,这是由于无菌生产工艺对环境系统的要求高,且影响无菌操作的因素多而使得无菌保证水平比终端灭菌工艺低。无菌工艺就是在洁净环境下将各种无菌组分、产品进行配制组合。
目前评价无菌生产工艺是否有效,更多注重无菌生产工艺的设计是否合理,所用的设备与工艺是否经过充分的验证,在此基础上,切实按照验证后的工艺进行生产,以保证灭菌 (无菌)工艺的可靠性。无菌药品的生产须满足其质量要求和保证药品效力的前提下,在生产过程中要最大限度的防止微生物、各种微粒和热原污染。对于注射剂来说,由于它可以快速进入血液,更快的发挥作用,如果产品本身不是菌的,病人的生命就会受到威胁,因此必须要保证无菌。
如何达到无菌的要求呢?
非最终灭菌工艺是在无菌系统环境下,通过无菌操作法或除菌过滤法,以防止污染为目的,消除导致污染的所有可能来保证无菌水平。其关键的操作步骤灌装和密封在极高质量的环境(B级背景中的A级)中进行。
对于最终灭菌工艺来说,最终灭菌工艺是在控制各工序生物负荷的基础上,在药品灌封后,通过湿热灭菌等方式除菌。其关键的操作步骤灌装和密封在高质量的环境(如C级背影下的A级)中进行;常用加热法或辐射法对装在最终容器中的产品进行灭菌。这些方法成本低,无菌保证水平高,适宜于大容量注射剂和小容量注射剂的灭菌。
常用“无菌保证水平”(SAL)来评价无菌工艺效果,SAL是指产品经灭菌/除菌后微生物残存的概率。该数值越小,表明产品中微生物存在的概率越小。
无菌制剂工艺设计,无菌制剂产品釆用何种工艺生产,是由产品特质决定的。基于“质量源于设计”的理念,在产品研发和扩大生产过程中积累的对产品和工艺的理解,最终体现在商品化生产的工艺设计之中。
最终灭菌工艺
应根据产品耐热特性,确定产品能否采用最终灭菌工艺。鉴于最终灭菌工艺的无菌保障水平远高于无菌生产工艺,法规监管机构要求注射剂尽可能采用最终灭菌工艺。
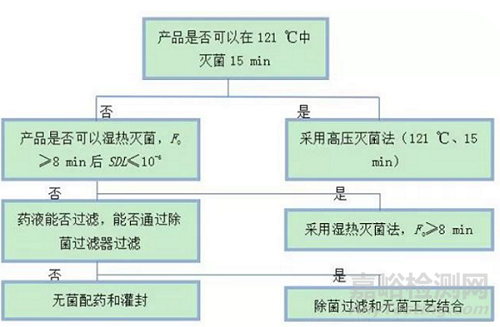
上图是EMA推荐的溶液剂型产品除菌工艺决策树
从图中可以看出,过度杀灭法是首选的灭菌方法,其无菌保证水平最高。除了产品的耐热性以外,产品的其他特性,如是否具有毒性、致敏性、能否促进微生物的生长等,也应该充分考虑。每种特性都对无菌制剂产品的工艺设计有着重大影响。此外产品的剂型和包装形式也会对工艺设计产生较大的影响。
质量风险管理在无菌药品生产中的应用,随着现代制药行业中质量风险管理的发展,风险评估被广泛应用在制药行业的各个领域和各个阶段。从工艺设计到性能确认、持续的维护改进,从原料药生产到无菌制剂,到处都可以看到风险评估的应用,我们依据质量风险管理工具,通过风险识别找到产生污染的风险点和最差条件,依据风险分析得出风险发生的严重性、可能性和可检测性,通过,风险评价定义出优先级别。并制定控制措施以使风险降低到可接受的程度。例如关键生产区域的操作人数,这是一个较大的风险点,如果人数过多,会影响到区域的粒子数和洁净度水平,因此我们在无菌工艺模拟的时候应进行最大操作人数的一个模拟,通过验证我们可以得出一个很安全的操作人数限值。并在大生产中对最多的进入关键区域人数更行一个规定。
无菌生产工艺的验证不是一个简单的检验过程,而是根据GMP原则进行的一系列活动,用以证明任何程序、生产过程、设备、物料、活动或系统确实能达到预期结果。要保证药品质量,预防与控制远比事后处理更加重要。在药品生产前,对药品的生产工艺进行系统规范的验证,可以从根本上保证药品的稳定性及有效性等。
“质量源于设计”(QbD)是一种系统的研究方法,即产品研发以预先设定目标为起始,根据合理的科学方法和质量风险管理,强调对产品和生产过程的认识。质量保证是建立在设计基础上,而不是通过对产品的检验得出来的,这个认识已经越来越被国际药品监管机构和药品生产企业所接受。
无菌制剂工艺验证是一项复杂的系统工程。全面的工艺验证既包括厂房设施、公用工程和工艺设备等“硬件”的确认,又包括人员培训、时限控制、无菌检测等“软件”的确认。其内部各系统之间有着科学、合理的逻辑联系。
要进行验证工作,就必须按照验证生命周期设计出一套完整的验证计划。验证活动中的很多因素都在不断发展变化,也必须不断地适应调整。如果出现问题,要进行相应的偏差调查和分析,对于不存在风险的则放行。反之,则要建立纠正预防措施,并做好验证。正常生产情况下,若未发生任何变更,应按时进行再验证。

来源:德大器械产业管家


