您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-10 16:09
API的固态研究应该贯穿整个药物研发阶段,一方面能够在药物研发早期对于药物的固体形态进行优势晶型的选择从而规避风险;对于仿制药企,通过研发不同的药物晶型并请求专利保护,能够绕开原研药厂的专利屏障,在与原研药企的竞争中另辟蹊径,在市场中博取一席之地。
晶型筛选方式:实验VS实验+预测

纯实验晶型筛选
传统药物固态形式的筛选流程是在设置大量筛选试验,得到小分子药物不同的潜在固体形态以后分别进行物理化学性质表征[1]。根据大量的表征数据,包括熔点、吸湿性、溶解度、稳定性溶出度、工艺可行性等筛选出优势晶型。再优化相关晶型的单晶培养条件,得到相应晶型的晶体学数据从而为申报做准备。从固态形式的表征到申报,药物要经历漫长的等待期,来探究药物的相关性质及优势晶型的单晶培养,这无疑会拖慢整个药物研发的进度。
实验+预测的晶型筛选
随着近年来研究的深入,越来越多的案例表明不同的晶体结构表现出不同的性能。这提示我们或许可以在筛选初期通过晶体结构对相应固体形态的物理化学性质、相对稳定性以及工艺可行性作出合理预判,进而加快药物研发的速度。例如吲哚美辛的α晶型比γ晶型更易于压片,这是由于γ晶型的晶体结构包含滑移面,这在一定程度上增强了分子压缩变形的能力。而α晶型因为更加紧密的分子排列显示出更优的可压缩性[2]。
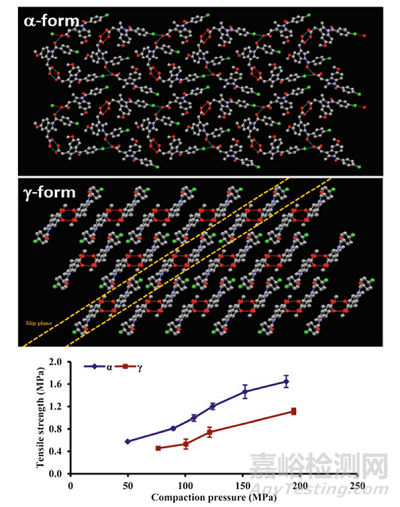
图3.吲哚美辛的α及γ晶型的分子排布及压力测试实验结果[2]
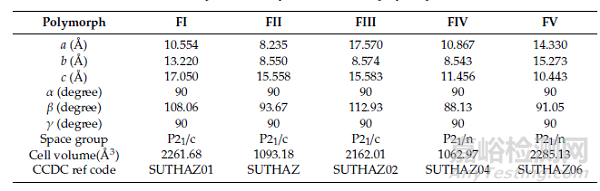
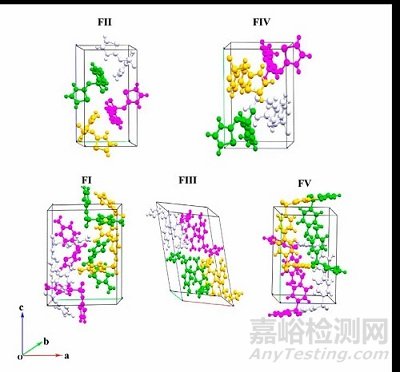
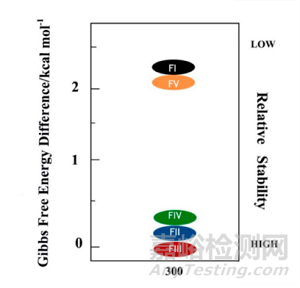
同时,根据不同药物晶型的晶体结构,可以计算出对应晶型的吉布斯自由能,根据吉布斯自由能推断晶型的相对稳定性,对于优势晶型的选择也具有指导意义[3]。例如,磺胺噻唑(一种典型的抗菌药物)存在五种多晶型(FI,FV, FIV, FII和FIII),根据各晶体结构数据计算出特定条件下吉布斯自由能最低的晶型,从而根据药物的应用场景选择合适的优势晶型。
(a)
(b)
(c)
图4.(a)磺胺噻唑的多晶型的晶体结构数据,(b)磺胺噻唑的多晶型的晶体结构,(c)300K下,磺胺噻唑的多晶型的晶体相对稳定性
“纯实验”对比“实验+预测”的晶型筛选
由此可见,晶型结构对于挑选优势稳定晶型具有无与伦比的优势。传统固体形态研究中,获得晶体结构的时机通常是经过了大量的筛选实验和各个固体形态的性能表征以后仅对优势晶型进行单晶培养,进而实现晶体的结构解析。而在知识产权之战的硝烟愈来愈浓的今天,药物研发企业更加倾向于解析所有固体形态的晶体结构,实现更加完美的专利布局。因此,对于药物研发团队来说,调整晶体结构解析的顺序,不仅能够指导后期筛选和工艺优化还能够在药物研发早期实现更加全面的专利布局。
MicroED解决“实验+预测“晶型筛选的关键瓶颈
然而,药物研发初期很少能够得到各个固体形态的完美晶体实现单晶解析。因此业内亟需推进新技术解决当前单晶培养难的问题进而加速药物研发的进程。MicroED技术能够越过单晶培养这一过程,直接在药物研发初期对粉末晶体进行结构解析,这无疑是广大药物研发企业的最强助力,具有深远而广阔的应用潜能。
微晶电子衍射(MicroED,Micro Electron Diffraction)是一种利用冷冻电镜解析微小晶体结构的技术,由于电子束与物质的作用远强于X射线,可以解析X射线晶体学难以处理的纳米晶体结构。
在药物小分子的固态研究领域,MicroED作为新工具能够助力固体形态筛选。由于测试的高效性和普适性,MicroED能够在筛选初期就对得到的微小晶体进行结构解析。根据不同药物固态的结构预测其理化性质及工艺可行性,实现对优势晶型的初步筛选,同时为药物申报做好万全准备。从而加速小分子药物的固态研究。
结论
因此,我们可以在药物固态研发早期通过MicroED解析出微晶的晶体结构预测不同的药物固态形式的物化属性之间的差异,例如熔点、密度、耐压性等等。这样不仅可以节省培养单晶所消耗的资源还能在稳定性、工艺可行性评估工作之前对药物优势晶型进行初步的筛选。从而避免大量资源的过多投入。
延伸阅读:药物的固体形态研究的重要性
药物固态形式的筛选是通过各种实验手段获得药物可能存在的各类固体型态,采用多种固态分析技术表征各种型态的物理化学性质,采用多学科综合手段评估优势型态的生物制药性能,以筛选出适合生产、生物利用度高、利于制剂的优势药物晶型。
众所周知,药物的固体形态会影响药物活性分子(ActivePharmaceutical Ingredient,API)的溶解度、溶出速率、熔点、稳定性、可压片性等性能,而这些性能对于药效和一致性至关重要。因此,在整个药物研发的过程中,都需要对原料药及制剂中原料药的固态形式进行监测,以保证各项特性及生物利用度的一致性[4-5]。药物分子的固态形式通常包括多晶型、盐型、共晶以及无定型。
对于药物研发团队来说,最幸运的情况莫过于在早期药代动力学研究中选定的优势晶型在产品上市以后依旧没有面临因转晶引起的药效或者一致性的风险。然而,人们常常认为这种乌托邦式的幻想与现实相去甚远。事实上,如果在药物研发中后期发现药物的固体形态发生改变往往要进行新的、更加全面的多晶型研究、结晶工艺的优化以及新的制剂开发。一旦面临这种情况,药物或将面临失去市场的风险。例如治疗艾滋病的利托那韦(ritonavir)在生产过程中出现的转晶现象,上市后一年多即发现该药物由晶型I转变成了晶型II,晶型II的溶解度较晶型I更低,从而使得药物的有效剂量降低,最终药物被迫从市场退出[4]。
另一方面,对于原研药企,通过申请药物晶型专利能够获得技术保护,在延长基础专利保护期的同时可形成对仿制药企业的专利障碍。例如葛兰素公司的抗溃疡药物雷尼替丁(zantac),晶型I专利到期后又发现了目前作为药物使用的晶型II,通过申请新的专利将其保护延长[6]。
综合以上,API的固态研究应该贯穿整个药物研发阶段,一方面能够在药物研发早期对于药物的固体形态进行优势晶型的选择从而规避风险;对于仿制药企,通过研发不同的药物晶型并请求专利保护,能够绕开原研药厂的专利屏障,在与原研药企的竞争中另辟蹊径,在市场中博取一席之地。
MicroED入选《Science》2018年度全球十大科技突破技术。
目前全球研究MicroED技术团队有美国的TamirGonen和瑞典斯德哥尔摩大学的XiaodongZou。TamirGonen团队的研究兴趣一直在生物大分子方面。XiaodongZou团队则在小分子方面获得了非常丰硕的研究成果,例如沸石、MOFs等的结构解析,目前,也在生物大分子的结构解析方面取得了非常好的进展,例如第一次通过MicroED实现了未知蛋白质的结构解析(DOI:10.1126/sciadv.aax4621)。MicroED技术已经趋于成熟,出现了一些提供MicroED服务的公司,例如美国的NANOIMAGINGSERVICES,国内有青云瑞晶。青云瑞晶的技术来自瑞典XiaodongZou团队,目前已经通过MicroED解出了几十种物质的结构,涵盖了药物小分子、蛋白质等。
[1] Darko F; Kristina S; et al. CrystalStructure and Physicochemical Properties of Crystalline Form of 2-O-{3-[(7-chloro-4-quinolinyl)amino]propyl}-9-deoxo-9a-methyl-9a-aza-9a-homoerythromycin. Journal ofPharmaceutical Sciences, 2011, 100, 2586–2598
[2] Aitipamula, S et al. Polymorphism inMolecular Crystals and Cocrystals. Advances in Organic CrystalChemistry: Comprehensive Reviews 2015, 265-298.
[3] Xuan H; Jinfeng L et al. CrystalStructure Optimization and Gibbs Free Energy Comparison of FiveSulfathiazole Polymorphs by the Embedded Fragment QM Method at theDFT Level. Crystals 2019, 9, 256-256
[4] Renu C; Anupam S et al. CrystalStructures and Physicochemical Properties of Four New LamotrigineMulticomponent Forms. Cryst. Growth Des. 2013, 13, 858−870
[5] ZhenguoG; SohrabR et al. Recent Developments in the Crystallization Process:Toward the Pharmaceutical Industry. Engineering,2017,3, 343-353.
[6] Armas H, Peeters O, et al. Solid statecharacterization and crystal structure from X-ray powder diffractionof two polymorphic forms of ranitidine base. J Pharm Sci. 2009Jan;98, 146-58.

来源:药事纵横


