您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-03 09:31
聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolicacid),PLGA)由两种单体——乳酸和羟基乙酸随机聚合而成,是一种可降解的功能高分子有机化合物,具有良好的生物相容性、无毒、良好的成囊和成膜的性能,作为药用辅料收录于美国药典,由于其降解程度随单体比不同而有差异,被广泛应用于缓控释制剂中,即通过改变乳酸与乙醇酸的比例,可以PLGA微粒制剂中药物分子的释放速率,其中PLGA微球作为蛋白质、酶类药物的载体是研究的热点。然而以PLGA为载体的制剂目前也存在一些缺点,包括载药量低,特别是亲水性小分子的载药量低、初始突释高和/或制剂稳定性差。有哪些可以解决这些问题的策略和新技术呢,下面我们通过这篇文章具体学习一下。
1 、利用可接受的释放速率曲线控制微粒载药量的挑战
1.1 药物的理化性质
尽管在同行评审的出版物和专利中描述了大量的微囊化方法,但聚合物颗粒中的亲水性分子比疏水性小分子更难被负载。因此将亲水性药物改性为疏水性药物通常是优化PLGA微球载药量最常用的方法。例如,可以将盐形式的亲水性小分子转化为疏水性更高的相应的游离酸或游离碱形式,来提高的药物负载量。
对于PLGA微粒,通过生物聚合物的扩散和/或均相的整体侵蚀来释放包封的药物,其扩散速率取决于药物的扩散率和分配系数。这些参数受药物的理化特性影响,例如分子尺寸,亲水性和电荷。相对较高含量的水溶性药物有助于水浸入颗粒中,并在药物浸出时形成高度多孔的聚合物网络。相比之下,疏水性药物会阻碍水扩散到微粒系统中,并降低聚合物降解的速度。Siegel等将六种具有不同化学结构的药物,即噻噻吩、氟哌啶醇、氢氯噻嗪、皮质酮、布洛芬和阿司匹林负载于PLGA(50:50)中,载药量均为20%,研究结果发现不同分子之间的释放率差异显著。因此,设计具有高载药量的可生物降解聚合物载体需考虑到封装药物本身的作用及生物聚合物的降解机理。
1.2 粒径
设计微粒给药系统的关键因素包括微球的大小和形态,因为这些参数可能会影响包封效率(EE)、产品可注射性、体内生物分布以及包封的药物释放速率、功效和副作用分布。通常,使用直径在10至200μm范围内的微球可获得最佳的释放曲线。对于粒径<10μm的微球,存在被免疫细胞吞噬的风险。另一方面,>200μm的微球可能会引起免疫反应和炎症。
大粒径微球相对于小粒径微球,比表面积变小了,导致水渗透率和基质降解速率降低,因此大粒径药物释放的速率可能会降低,作用持续时间可能较长。因此,因此,充分了解生物聚合物组成、微粒形态和大小之间的关系对于定制生产具有预先确定的药物释放曲线的微粒材料至关重要。但是,基于PLGA微球的各种封装的药物释放曲线的多样性,释放率不一定符合预测的行为,只能定量预测微粒大小对某些定义明确的制剂的药物释放动力学的影响
2 、 PLGA微球的降解机理
驱动PLGA微球药物释放的两个主要机制是扩散和降解/侵蚀(Kamaly等人,2016)。对于PLGA(50:50)粒子,药物释放分为两个阶段。在第一阶段,分子量迅速下降,但质量损失很小,而在第二阶段,则相反。这表明PLGA颗粒降解涉及多相机制,药物释放主要由扩散而不是聚合物降解支撑(Engineer等人,2010)。
PLGA是一种典型的大体积侵蚀性生物聚合物,因此水很容易渗透到聚合物基质中形成孔隙,从而在整个微球中发生降解(Varde和Pack,2004)。表面腐蚀的生物高聚物(如聚(邻位酯)(POE)和聚酸酐)与本体腐蚀的生物高聚物(如PLGA)的包封药物释放曲线缺乏比较。因此,需要进一步研究解决这一知识缺口,以便更好地为具有所需释放曲线的微粒制剂的设计提供信息,其中可能包括包含混合块状和表面侵蚀生物聚合物的制剂。
2.1 生物聚合物的物理化学性质
对于包裹在PLGA微粒中的药物,可通过调节乳酸与乙醇酸的比率并通过改变影响微粒形态的物理化学性质[例如,端基(酯或羧基)功能性]来实现所需的释放速率。PLGA颗粒的物理性质还取决于药物递送装置的尺寸、表面形状以及储存温度和湿度。这些特性不仅影响生物聚合物的配制能力,还影响其降解率。另一个有助于PLGA微球包裹药物释放的因素是在配制过程中有机溶剂中聚合物的浓度(Wasana等人,2009)。
2.2 表面活性剂的选择
在使用传统溶剂蒸发方法制备微粒的过程中,需要使用乳化剂来确保液滴的稳定性,直到有机溶剂中的聚合物浓度足够高以维持微粒构象(Chemmunique,1980;Hwisa等人,2013)。制备PLGA微/纳米颗粒中使用最广泛的乳化剂是聚乙烯醇(PVA)。值得注意的是,D-生育酚聚乙二醇1000琥珀酸盐(维生素ETPGS;FDA批准作为水溶性维生素E营养补充剂)在浓度比PVA(5mg/ml)低一个数量级(0.3mg/ml)时显著改善药物载量(Feng等人,2007)。
3 、缓释制剂用微粒的制备方法
药物,包括许多小分子,是可溶于聚合物溶液,可以通过简单地与聚合物共溶封装,这是最常用的方法。
对于小分子药物的水溶性盐,通过将其转化为疏水形式,例如通过与离子表面活性剂络合或转化为相应的游离酸或游离碱形式,可以提高包封效率。替代方法包括在聚合物溶液中悬浮固体(例如冻干)颗粒;或通过使用水包油(w/o/w)溶剂蒸发(双乳液)方法,控制较小的内水相体积、较低的制备温度和外部相合适pH值可以实现相对较高的载药量和可再现的持续释放曲线。
在下面的章节中,我们将对利用合适的缓释曲线实现高载药量的新技术和方法进行综述。
3.1 PLGA基水凝胶模板给药系统的研究进展
水凝胶模板能够实现高载药量(∼50%)和高掺入效率(∼100%),并且适用于小分子和生物制剂。任何不溶于水的材料都可以用作微粒基质以实现所需的药物释放曲线,并且微粒可以从易溶解的水凝胶模板中回收。该技术可以精确控制每个维度上模板孔的大小和形状,从而可以制备粒径分布范围较小的微粒,这些特性可以制备成用于注射到敏感部位(如眼睛)的缓释微粒,在超过3个月的时间内几乎零级药物释放,几乎没有初始的突发释放。然而,需要更多的研究来更好地理解微粒大小和形状对具有不同物理化学性质的大范围分子的包封药物释放动力学和体内性能的影响。

图1水凝胶模板法
3.2 同轴电喷雾
同轴电喷雾(CES)利用施加在外部(PLGA载体)和内部(载药)溶液上的电场,通过同轴针的两个单独进料通道同时喷射到一个喷嘴中,产生双层微粒(Yuan等人,2015)。在一定的电压阈值下,锥形(如“泰勒锥”)形成,液体射流(内外流)被破碎成双层微粒。在CES工艺中,在喷嘴顶部形成具有核壳结构的复合泰勒锥,外部聚合物溶液包裹内部液体。通过库仑排斥作用,大块液体被破碎成带电荷的小液滴。利用这项技术,可以控制喷射方向、材料流速和溶剂萃取速率等参数,以形成均匀且中心良好的双壁微球,显示出可控的壳厚度(Makadia和Siegel,2011)。CES工艺能够高效、最低限度地封装蛋白质、药物和造影剂,并能很好地控制核壳结构。
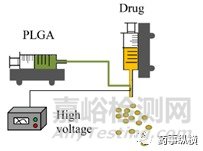
图2同轴电喷雾(CES)示意图
3.3 微流控制造
微流控装置利用静电力控制颗粒的大小和形状,以增强药物释放特性的调节。微流控系统已用于制造具有精确尺寸和组成的复杂药物载体,从而产生可预测和可调节的释放曲线。通过两个单独的入口注入两个连续且不混溶的流体(即油和水),由于高剪应力,两股水流相遇产生单分散液滴(如图3)。液滴尺寸范围为20-100μm和100-300nm。与经典的双乳化方法相比,微流控装置中的一步乳化很容易产生多组分。通过引入第二流,液滴可以被重新封装,这对于制备核壳结构是有用的。
新颖的通用的微流控方法制备PLGA/PCLJanus(指表面具有两种及两种以上独特物化性质的纳米粒子)和微胶囊粒子涉及将分散相的有机溶剂从碳酸二甲酯改变为二氯甲烷。微胶囊颗粒表面的外壳仅由PLGA组成,核心由嵌入微小的PLGA珠的PCL组成。有趣的是,Janus和微胶囊颗粒表现出不同的降解行为,这意味着它们对药物递送和释放曲线的潜在差异效应。
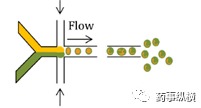
图3微流控示意图
3.4 超临界CO2
超临界CO2(scCO2)提供了传统微粒制剂技术的“绿色”替代方法,因为它避免使用有毒有机溶剂或高温。由于在相对较低的温度和适度的压力下进行非常短的包封过程(5-10分钟),并且没有有机溶剂,包括蛋白质在内的生物活性分子的活性得以保持。因为整个过程是无水的,所以可以用来生产多种亲水分子的缓释制剂。
使用scCO2技术的新变体利用了CO2的其他特性,例如其从天然化合物中提取活性药物成分(API)或形成聚合物的能力。正在开发的新方案有望使用scCO2浸渍工艺制造药物洗脱植入物。

图4超临界CO2法
3.5 喷雾干燥
载药/蛋白质/肽微球可通过在加热空气流中喷涂油包固体分散体或油包水乳液来制备。用于包封的药物类型(疏水性或亲水性)决定了所用溶剂的选择和性质,而溶剂蒸发步骤的温度和进料速率影响微球形态。
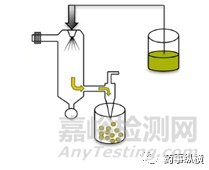
图5喷雾干燥法示意图
3.6 聚合物自愈合
“自愈合”是一种现象,即具有受损结构(例如,孔隙、裂缝和凹痕)的聚合物经历聚合物链的自发重排以产生愈合(修复)。这一点很重要,因为生理温度下PLGA微粒中的孔闭合阻碍了孔扩散途径,并大大减少了微囊化肽的初始爆裂释放。类似地,通过溶剂蒸发技术制备并使用表面活性剂pluronicF127(聚氧化乙烯-聚氧化丙烯-聚氧化乙烯三嵌段共聚物)作为成孔剂的载有重组人生长激素(rhGH)的多孔PLGA微球暴露在溶剂后在聚合物表面进行孔闭合。这些“治愈”的非多孔微球在很长一段时间内表现出持续的药物释放特征。后修复方法可用于克服剪切引起的微粒降解、与溶剂相关的核心材料的腐蚀或乳化过程中药物的突释。“修复”微粒表面孔隙的策略包括溶剂溶胀或红外辐射,这可能是更温和的诱导自我修复的方法。
3.7 添加剂络合PLGA
如本综述前一节所述,PLGA微粒给药系统的化学成分极大地影响其物理化学性质,进而控制胶囊药物的生物分布和药代动力学。因此,PLGA与适当添加剂的络合作用,包括聚乙二醇(PEG)、POE、壳聚糖和/或海藻酸盐、咖啡酸、透明质酸、TPGS和SiO2,可能导致更高的载药量和所需的缓释曲线。
其他有望改善可控释药系统的策略包括双壁/层状PLGA和微粒中的纳米颗粒。此外,由于控制颗粒形状的方法的多功能性和可控性,基于高聚物分子刷PLGA的药物递送系统似乎很有前景。
4、 结论
在过去的十年中,在解决(i)低载药量,(ii)粒子不稳定性和(iii)基于PLGA的微粒药物递送系统的药物释放曲线的充分控制方面取得了相当大的进展。提高PLGA微球载药量的策略包括改进传统的溶剂蒸发法,制备多层微粒,以及开发新的微粒制备方法,包括水凝胶模板法、同轴电喷雾法、微流体法和scCO2法。此外,将PLGA与PEG、POE、壳聚糖和/或海藻酸钠、咖啡酸、透明质酸和SiO2等添加剂络合的方法也很有前景。然而,在开发控制影响药物载量和释放曲线的因素的时效性方法方面非常需要创新,作为下一代控释药物递送系统设计的一种手段。

来源:Internet


