您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-02 23:55
1977年9月16日,世界上第一例冠脉介入由Grüntzig医生于瑞士苏黎世完成,仅使用球囊将38岁男烟民的LAD近端病变进行了扩张,取得了良好的效果。但并非每个患者都如此幸运,早期单纯球囊扩张的再狭窄率高的惊人,促使1986年冠脉支架的诞生。心内科医生会冠脉介入的不少,但真正了解支架的人却不多。

图1 7种支架的micro-CT图像
这是7种支架在micro-CT下的图像。与临床中用到的CT相同,科研用的micro-CT同样使用X线扫描来重建图像,只不过成像精度更高,可以达到μm级。与那些“图片仅供参考,请以实物为准”的商品不同,冠脉支架在设计图上和在micro-CT下差别并不大,但不要忘了它们的实际大小往往连一个指节都不到,因此可以说是顶尖制造水平的体现。
让我们随着冠脉支架制作的步骤,来看看一块原材料在经历了怎样的考验后才能成为冠脉医生手中开通血管的利器。
步骤1、 选择支架材料
支架材料决定了设计、加工、使用中的方方面面,因此选择合适的材料非常重要。
早期冠脉支架主要由316L不锈钢制成,其中约70%为铁元素,加入了少量镍、铬、钼。316L不锈钢有几个缺点,首先是密度较低,X光下可见性较差,需要加入其它高密度金属来改善可见性,但可能造成额外的血管壁炎症。其次316L钢耐腐蚀性差,释放出的镍离子对血管壁有害,需要特殊工艺进行弥补。最重要的是316L钢的机械强度不高,往往需要更厚的支架梁来保证结构稳定。
钴铬合金(CoCr)、铂铬合金(PtCr)的机械强度较316L钢高,因此可以将支架梁制作的更薄,对血流的影响更小,也更容易内皮化。由于密度较高,X光下显影效果好。在核磁下,CoCr相比不锈钢伪影较小,对核磁观察更加友好。新一代的金属支架绝大多数由CoCr或PtCr制成。
镍钛合金(NiTi)主要用于制作自膨胀支架。NiTi弹性好,且具有形状记忆的特性,在递送过程中是折叠的,一旦到达病变后因为温度升高可以自动膨胀回支架形状。不过镍离子对血管壁存在毒性,需要特殊处理以减少影响;另外NiTi在X光下可见性较差,也需要添加不透X光的物质。
可降解支架大多数仍在研发过程中,目前披露的资料中聚合乳酸使用最广泛(逐渐降解为H2O与CO2),但机械强度较差,支架梁往往偏厚,对内皮化及局部血流不利,且降解过程中存在支架断裂散架的问题。镁、铁等新材料可以反应为可溶盐而降解,但能否克服聚合乳酸的弱点尚需进一步研究。
步骤2 、进行支架设计
支架类似于一圈圈的金属环(ring)叠在一起,由连接体(connector)将金属环连在一起,最终形成圆柱型结构。相邻2个金属环与相邻2个连接体围成的区域称为1个单元(cell)。支架对血管壁的径向支撑力主要由金属环提供,而支架适应血管走行的弯曲能力则由连接体提供。
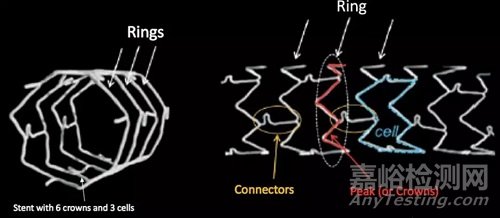
图2 金属环、连接体与支架单元
连接体少一些,支架适应血管走行的弯曲性更好,更方便在钙化迂曲的冠脉中穿行至病变,但变形的风险更高;连接体多一些,结构确实更稳定,但也更难弯曲。
如果在每个环上的拐点都有连接体,被称为闭合单元(closed cell);如果隔几个拐点才有连接体,被称为开放单元(open cell)。闭合单元的好处在于对血管壁支撑更完全,对斑块的覆盖更好,但容易堵塞侧壁的分支血管;开放单元虽然对分支血管更加友好,也对内皮覆盖有好处,但更容易变形,更容易让斑块凸入管腔形成内膜脱垂。

图3 闭合单元与开放单元
连接体与金属环的连接方式,目前主要有4种(如下图),①峰-连接体-谷,②峰-连接体-峰,③峰-连接体-峰(金属圈未对齐),④支架梁中央-连接体-支架梁中央。
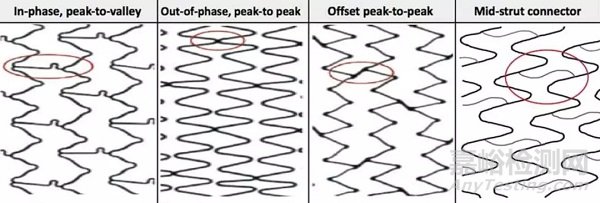
图4 支架连接体与金属环的不同连接方式
正如上面所说,设计上的差异会带来不同的优点与缺点,因此没有什么设计是完美的,都需要进行权衡。
步骤3 、支架精密加工
有了理想的材料与周密的设计,接下来是将材料变成支架。
最常见的支架加工技术是激光切割。将金属加工为非常光滑的金属管后,根据设计图纸使用高能量的激光照射金属管,照射之处金属熔化甚至直接汽化,再通过高压气流将这些废料吹走。由于激光导致的加热效应并不完全局限于切割部位,会对表面光滑度等造成影响,需要很复杂的后期处理来使之成为合格支架。

图5 激光切割支架
除激光切割外,还有一些技术被应用于支架制作。比如广泛应用于芯片制作的光蚀刻技术,利用电极放电能量的电蚀刻技术,利用电镀技术一层一层铸出支架的电铸技术,或通过模具将金属铸造为支架、将金属丝编织焊接为支架等。但因为各种原因,这些技术不如激光切割使用广泛。更多的新技术正在尝试使用中,比如大热的3D打印技术,尽管在制造支架时存在困难,但未来仍存在广阔的应用前景。
步骤4、 选择抗增殖药物
支架放置在血管中,逐渐被内皮细胞覆盖是好事,可以大大减少支架作为异物促进血栓形成的风险。但如果新生内膜长得太厚,就会导致支架内再狭窄。保持支架内血栓与支架内再狭窄的平衡很难。
裸金属冠脉支架刚被发明时,新生内膜爬的很快,支架内再狭窄非常常见。为了应对再狭窄,支架梁上开始使用抗增殖药物,但太强的抗增殖效果又影响内皮化,因此频繁出现支架内血栓。当前使用的支架全都是新一代药物洗脱支架(DES),平衡了支架内再狭窄与支架内血栓的风险,使得总体风险最低。
应用在冠脉支架的抗增殖药物主要有2大类, mTOR抑制剂与紫杉醇。
最早发现的mTOR抑制剂是雷帕霉素(rapamycin,又称为sirolimus),因发现于复活节岛(Rapa Nui)而得名,而mTOR(mammalian target of rapamycin)的名字又来自于雷帕霉素。mTOR抑制剂的作用机制比较复杂,主要靠抑制从G1期进入S期而抑制增殖。早期雷帕霉素支架的代表产品是Cypher,相比裸金属支架大大降低了支架内再狭窄风险,但因支架内血栓风险高已被淘汰。现在仍有很多支架在使用雷帕霉素,但聚合物涂层技术已与Cypher大大不同,在下一节中会提到。
基于雷帕霉素的几种新型mTOR抑制剂均以-limus结尾:依维莫司(everolimus)、佐他莫司(zotarolimus)与百奥莫司(biolimus A9)。这几种新药脂溶性更好、转移效率更高,对内皮化的影响更小,同时也没有丢掉优秀的抑制新生内膜增殖的特性。依维莫司永久涂层支架是新一代DES中研究最多的,再狭窄与支架内血栓风险均较低,可以称为“金标准”。近年很多支架被证明效果不劣于依维莫司永久涂层支架,今后会不会有更理想的支架、依维莫司永久涂层支架是否能继续作为“金标准”仍未可知。
紫杉醇(paclitaxel)因分离自太平洋紫衫(Taxus brevifolia)而得名。紫杉醇的主要作用机制是在细胞增殖的M期阻止微管蛋白的降解,导致细胞无法分裂。最早的紫杉醇支架直接以紫衫树命名(Taxus),与Cypher同样的原因已经见不到了。现在紫杉醇主要用在药物球囊上,因为紫杉醇相比雷帕霉素脂溶性好、转移效率高、喷涂工艺简单,绝大多数药物球囊(DCB)使用紫杉醇,但近年也有DCB尝试雷帕霉素。
步骤5 、覆盖聚合物涂层
聚合物是抗增殖药物储存的溶剂,绝大多数支架都需要覆盖聚合物涂层来储存抗增殖药物。除储存外,聚合物涂层也决定了抗增殖药物的释放速度。目前涂层主要分为3类,永久涂层、可降解涂层与无涂层。涂层所用材料的中文名称非常复杂,下文中仅用英文简写。
早期永久涂层支架的血栓风险除了抗增殖药物以外,涂层生物相容性差也是重要原因。Cypher与Taxus两款DES的鼻祖分别使用了SIBS与PEVA+ PBMA作为涂层,均为永久聚合物涂层,然而两者的涂层均会缓慢引起炎症并增加血栓风险。在药物释放上,Cypher的涂层可以保证雷帕霉素在前30天释放80%,Taxus的复杂涂层则保证紫杉醇在前10天仅释放<10%,剩余的药物终身缓慢释放。
新一代永久聚合物涂层采用的BioLinx、PVDF-HFP等生物相容性较好,可以大大改善内皮愈合并减轻炎症。金属表面容易形成血栓,永久聚合物涂层还可以起到隔绝金属与血液的作用。尽管聚合物永久存在,但抗增殖药物很快就会耗竭,比如PVDF-HFP涂层在置入第1天就会释放25%的依维莫司,1个月内释放75%,4个月时基本完全释放;而BioLinx涂层在60天内释放85%的佐他莫司,180天基本完全释放。
可降解涂层使用聚合乳酸与PLGA等可在体内降解的聚合物,最快的可以在2个月内降解,慢的可能需要9-15个月,早在聚合物降解前抗增殖药物就已经释放完毕(1-4个月)。永久涂层的药物完全释放并不是真正意义上的“完全”,因为聚合物仍会持续微剂量释放药物,可能促进新生动脉粥样硬化与内皮愈合不良。可降解涂层在一些病理研究中优于新一代永久涂层,但在现有的临床研究中效果与永久涂层效果类似,可能需要更长时间的随访来观察涂层降解是否有额外获益。
近年出现的无涂层支架不使用聚合物,需要特殊设计以携带药物,对支架所用的材料及加工技术要求非常高。现有的技术可以在支架梁靠近血管壁的一侧打上大孔或微孔来放置药物,还有些支架的特殊技术允许直接在金属表面涂抹药物。除难以携带药物外,无涂层还存在药物迅速流失的问题,需要使用特殊手段以减缓药物释放。几种无涂层支架在临床研究中的效果与新一代永久涂层支架类似,与可降解涂层一样,无涂层设计是否具有额外获益一样未知。
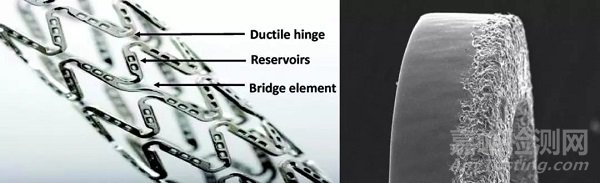
图6 无涂层支架表面携带药物的大孔与微孔
结语
从原材料到一枚支架诞生,需要精心的设计与高超的加工手段。除了本文中说到的制造过程外,后期进行大规模临床研究必不可少,只有临床研究中证明安全有效后获得CFDA的批准,冠脉医生才能使用到它。
不断进化的支架技术固然重要,但做好冠心病的预防、避免支架更加重要,正所谓“不治已病而治未病”,我们也期待有更为先进的技术取代“支架”,让患者得到更加完美的“介入治疗”。
参考文献:
[1] Torii S, Jinnouchi H, Sakamoto A, et al. Drug-eluting coronary stents: insights from preclinical and pathology studies[J]. Nature Reviews Cardiology, 2019: 1.
[2] Byrne R A, Stone G W, Ormiston J, et al. Coronary balloon angioplasty, stents, and scaffolds[J]. The Lancet, 2017, 390(10096): 781-792.
[3] Chichareon P, Katagiri Y, Asano T, et al. Mechanical properties and performances of contemporary drug-eluting stent: focus on the metallic backbone[J]. Expert review of medical devices, 2019, 16(3): 211-228.
[4] Watson T, Webster M W I, Ormiston J A, et al. Long and short of optimal stent design[J]. Open heart, 2017, 4(2): e000680.
[5] Schmidt T, Abbott J. Coronary stents: history, design, and construction[J]. Journal of clinical medicine, 2018, 7(6): 126.
[6] Guerra A J, Ciurana J. Stent’s Manufacturing Field: Past, Present, and Future Prospects[M]//The Perfect Stent-Dreams and Realities of Coronary Interventions. IntechOpen, 2018.
[7] Habib A, Finn A V. Antiproliferative drugs for restenosis prevention[J]. Interventional cardiology clinics, 2016, 5(3): 321-329.
[8] Rizas K D, Mehilli J. Stent polymers: do they make a difference?[J]. Circulation: Cardiovascular Interventions, 2016, 9(6): e002943.
[9] O’Brien B, Zafar H, Ibrahim A, et al. Coronary stent materials and coatings: a technology and performance update[J]. Annals of biomedical engineering, 2016, 44(2): 523-535.
[10] Kommineni, N., Saka, R., Khan, W. et al. Non-polymer drug-eluting coronary stents[J]. Drug Deliv. and Transl. Res. (2018) 8: 903.

来源:医脉通心内频道


