您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-19 16:17
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
科兴中维新冠疫苗在巴西获紧急使用授权。当地时间1月17日,巴西国家卫生监督局(ANVISA)宣布授予科兴控股旗下北京科兴中维研发的“新冠灭活疫苗”克尔来福在巴西的紧急使用许可。当天获得紧急使用许可的还有牛津大学和阿斯利康合作研发的新冠疫苗。巴西计划从18日开始向各州分发疫苗。克尔来福仅需在2至8摄氏度的疫苗常规储存温度下保存,在疫苗物流运输上更具优势。
国内药讯
1.扬子江丙泊酚获批上市。扬子江4类仿制药丙泊酚中/长链脂肪乳注射液获国家药监局批准上市并视同通过一致性评价。丙泊酚中/长链脂肪乳注射液是临床常用的麻醉剂之一。据米内网数据,2019年在中国公立医疗机构终端该品种销售额接近20亿元,原研费森尤斯卡比的市场份额持续下滑,2020上半年仅剩52.22%。扬子江药业是继盈科生物和科伦药业之后该品种第三家通过一致性评价。
2.海思科脂肪乳氨基酸(17)葡萄糖(11%)注射液通过一致性评价。海思科脂肪乳氨基酸(17)葡萄糖(11%)注射液以补充申请获批通过一致性评价,为科伦药业之后该产品第二家过评企业。脂肪乳氨基酸(17)葡萄糖(11%)注射液主要用于功能不全或不能经口/肠道摄取营养的成人患者的营养补充。据米内网数据,2019年在中国公立医疗机构终端该品种销售额超过19亿元,其中原研费森尤斯卡比华瑞制药仍占市场大头。
3.三迭纪3D打印药物获FDA临床批准。三迭纪医药首个3D打印药物产品T19获FDA的新药临床试验批准(IND)。该产品是全球第二款向FDA递交IND的3D打印药物产品,也是中国首个进入临床阶段的3D打印药物产品。T19所使用的MEDTM 3D打印技术为三迭纪全球首创,它根据药用辅料的特征为药物领域的应用量身定制。MEDTM 3D打印可直接将粉末状的原辅料软化或熔化成可流动的半固体,再以高精度挤出,最后层层打印成型,制备成预先设计的三维结构药物制剂。
4.海思科1类创新药环泊酚在美获批临床。海思科子公司美国海思科药业在美国提交的环泊酚乳状注射液(HSK-3486)的Ⅲ期临床试验申请获FDA批准。HSK-3486是海思科开发的一款具有自主知识产权的静脉麻醉药物,属于短效GABAA受体调节剂。该新药已于2020年12月在中国获批上市,用于消化道内镜检查中的镇静;其用于“全身麻醉诱导”的新适应症上市申请也获CDE纳入优先审评。本次在美国获批的临床适应症为全麻诱导。
5.拓臻生物纳斯达克递交IPO。拓臻生物拟募资1亿美元向美国证券交易委员会(SEC)递交了纳斯达克上市申请,联席账簿管理人有摩根大通,高盛集团和科文公司。拓臻生物专注于开发治疗非酒精性脂肪性肝炎(NASH)、肝纤维化和肝细胞癌等慢性肝脏疾病的全新疗法,目前已建立了从非酒精性脂肪性肝病、脂肪变性到NASH,肝脏炎症到纤维化的全方位慢性肝病产品组合。其中,FXR激动剂TERN-101和SSAO抑制剂TERN-201均已获得FDA针对治疗NASH适应症的快速通道资格。
国际药讯
1.ViiV多替拉韦新剂型获欧盟批准上市。欧盟委员会(EC)批准ViiV Healthcare多替拉韦分散片Tivicay (5mg)上市,联合其他抗逆转录病毒药物,用于治疗年龄≥4周、体重≥3公斤、初治或经治(但没有接受过INSTI治疗)的HIV-1儿科感染者。Tivicay分散片能够迅速在水中分解制成混悬液,为给婴幼儿服药提供了便利。此次批准还包括更新的Tivicay(10mg、25mg、50mg)薄膜衣片剂量建议,用于年龄≥6岁、体重≥14公斤的HIV-1儿童感染者。
2.GSK公布在研PD-1在dMMR实体瘤中的阳性数据。葛兰素史克(GSK)在ASCO GI2021会议上公布其在研PD-1抗体dostarlimab来自GARNET研究F队列的最新数据。F队列研究主要评估dostarlimab在错配修复缺陷(dMMR)的非子宫内膜晚期实体瘤中的作用。研究结果显示,dostarlimab在dMMR晚期实体瘤患者的客观缓解率(ORR)为38.7%(N=106,95%CI;29.4-48.6);在中位随访12.4个月后,中位缓解持续时间尚未达到,且不同类型的肿瘤均有持久的缓解。
3.吸入疗法Tyvaso治疗PH-ILD达Ⅲ期主要终点。United Therapeutics公司吸入疗法Tyvaso(曲前列尼尔)治疗间质性肺病相关肺动脉高压(PH-ILD)的Ⅲ期临床INCREASE积极结果发表在《新英格兰医学杂志》上。主要疗效分析数据显示,Tyvaso治疗可使患者6 min步行距离(6MWD)显著增加31米(p<0.001),而且各个亚组中均观察到Tyvaso治疗的获益。该研究达到了所有主要和次要终点,包括临床恶化风险降低、用力肺活量(FVC)改善和基础肺病加重减少等。
4.安斯泰来mirabegron获FDA优先审查。FDA受理安斯泰来(Astellas)mirabegron(米拉贝隆)口服混悬剂的新药申请(NDA)以及Myrbetriq(米拉贝隆)片剂的补充新药申请(sNDA),用于治疗年龄≥3岁的神经源性逼尿肌过度活动症(NDO)儿科患者。FDA同时授予了优先审查资格, PDUFA目标日期为2021年3月28日。NDO是一种由神经损伤引起的神经性膀胱功能障碍。NDO患儿的膀胱可能会出现不自主的收缩,这将导致尿急、尿频和尿失禁等症状。
5.双特异T细胞衔接蛋白疗法获FDA孤儿药资格。FDA授予Harpoon Therapeutics创新靶向药HPN217孤儿药资格,用于治疗多发性骨髓瘤(MM)。HPN217是基于Harpoon公司T细胞活化构建平台TriTAC开发的、靶向BCMA的双特异性T细胞衔接蛋白(BiTE),正在Ⅰ/Ⅱ期临床中评估用于治疗复发/难治性多发性骨髓瘤(RR MM)的潜力。目前,该疗法由Harpoon与艾伯维共同开发,预计今年下半年启动剂量扩展研究。
6.ViGeneron联手第一三共开发创新眼科基因疗法。基因疗法公司ViGeneron与第一三共制药将利用ViGeneron专有的、腺相关病毒(vgAAV)载体开发技术,共同开发一种可通过玻璃体注射、用于治疗常见眼科疾病的基因疗法。根据协议,第一三共和ViGeneron将共同进行第一阶段的研究,第一三共将有选择权就这种常见眼科疾病的一个未公开的治疗靶点进行后续合作协议的谈判。双方合作的财务条款没有披露。
医药热点
1.第四批国家药品集采启动。1月15日,国家组织药品集中采购和使用联合采购办公室发布《全国药品集中采购文件(GY-YD2021-1)》,正式启动第四批国家组织药品集中采购和使用工作。第四批国家药品集采的开标时间为2月3日,按照计划,共有45个品种、80个品规的药品被纳入。据悉,我国此前已开展了三批国家药品集采,覆盖的药品平均降价54%,每年节约费用530多亿元。
2.《突发公共卫生事件医院管理实践》发布。国家重大公共卫生事件医学中心于14日发布《突发公共卫生事件医院管理实践》。该书由华中科技大学同济医学院附属同济医院主编、人民卫生出版社出版,历时8个多月编写,详细介绍了以新冠肺炎疫情为代表的突发公共卫生事件下的医院管理。是国内首部应对突发公共卫生事件的医院全面专业管理类书籍。
3.北京市将建四级社会心理服务网络。北京市地方标准《社会心理服务站点服务规范》日前向社会公开征求意见。按照“一基地+多中心+广站点”工作模式,北京市将建立市、区、街道(乡镇)、社区(村)四级社会心理服务阵地。这是全国首个社会心理领域标准,重点规范了社会心理服务站点的基本要求、服务内容、服务流程、服务评价与改进等内容。意见稿还提出,每个社会心理服务站点至少应有两名专职的社会心理指导人才。
股市资讯
【舒泰神】公司及全资子公司德丰瑞研发的BDB-001注射液完成在新型冠状病毒(2019-nCoV)感染患者中的安全性、耐受性、药代动力学和药效学Ib期临床研究和在健康受试者中单中心、随机、双盲、安慰剂对照的多剂量、单次、多次给药的耐受性、药代动力学Ic期临床试验的临床研究报告。
【健友股份】子公司健进制药的白消安注射液(规格:10ml:60mg)和注射用盐酸苯达莫司汀(规格:25 mg、100 mg)获药品注册证书。
【恒瑞医药】公司的盐酸伊立替康脂质体注射液获《药物临床试验批准通知书》。
审评动向
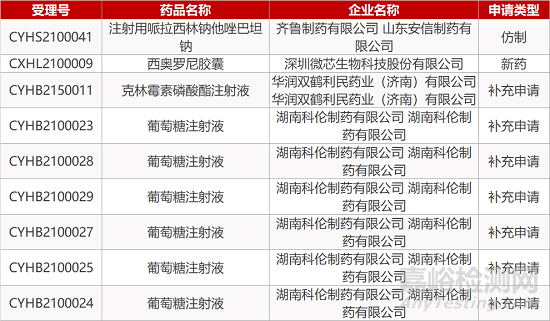
暂无
- The End -

来源:药研发


