您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-11 09:08
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国家药监局批准首款“数字药品”。尚医信息科技宣布其开发的一款名为术康的APP产品已通过国家药监局(NMPA)批准。该产品以心肺、肌骨、营养的远程智能评估为核心,结合可穿戴设备和预包装医用食品的科学组合,主要适用于慢病及慢性疼痛患者的康复,以及需要进行心肺功能提高的疾病,如高血压、糖尿病、高血脂、肿瘤术后等。在远程智能评估中,患者可获得个性化运动处方,佩戴智能硬件跟着康复训练视频运动就能完成治疗过程。这是中国境内首款获批的“数字药品”。
国内药讯
1.贝达药业恩莎替尼即将获批。贝达药业恩莎替尼上市申请评审状态变更为“离开第二轮补充资料任务”,此前该品种已完成了生产现场检查,完成两轮发补后,恩莎替尼预计即将获批上市。盐酸恩莎替尼(X-396)是贝达药业拥有完全自主知识产权的新一代ALK抑制剂。NMPA于2018年12月受理了恩莎替尼的上市申请,用于此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者。
2.基石药业新型IDH1抑制剂在新加坡申报上市。基石药业宣布已向新加坡卫生科学局(HAS)递交了ivosidenib的新药上市申请,用于治疗携带易感异柠檬酸脱氢酶-1(IDH1)突变的成人复发或难治性急性髓系白血病(R/R AML)患者。ivosidenib是基石药业合作伙伴Agios公司开发的一种同类首创口服IDH1抑制剂,也是全球首个唯一获FDA批准治疗IDH1突变R/R AML的药物。此次是基石药业首次在大中华以外地区递交新药上市申请。
3.贝瑞森制药孟鲁司特钠改良新药申报临床。贝瑞森制药提交的孟鲁司特钠凝胶临床申请获CDE受理,这是首个按2.2/2.4类申报的孟鲁司特钠改良型新药。孟鲁司特钠是由默沙东原研的一种强效选择性白三烯受体拮抗剂(Singulair,顺尔宁),能特异性抑制气道中的半胱氨酰白三烯受体,从而起到改善气道炎症,有效控制哮喘症状的作用。原研产品有3种剂型(片剂、咀嚼片和颗粒),目前国内尚无改剂型的产品获批上市。
4.中生尚健CD47靶向创新药获批临床。中生尚健注射用SG404获国家药监局一项临床试验默示许可,拟开发用于治疗恶性肿瘤。中生尚健是尚健生物和国药中国生物成立的合资公司。SG404是由尚健生物自主开发的靶向CD47的重组人SIRPα-Fc融合蛋白。SG404通过亲和力及结构优化,可有效阻断CD47-SIPRα信号通路,且不引起红细胞凝集。临床前研究显示,该产品的安全性和有效性均显著优于同类分子。
5.恒瑞2款新药获批临床。11月9日,恒瑞发布公告,2款新药获批临床,分别为AR受体拮抗剂SHR3680,获批开展SHR3680联合雄激素去除疗法(ADT)对比比卡鲁胺联合ADT治疗高瘤负荷的转移性激素敏感性前列腺癌的III期临床研究(SHR-3680-III-HSPC)。另一款是小分子TPO-R激动剂海曲泊帕乙醇胺片,获批在儿童和青少年慢性原发免疫性血小板减少症患者中开展一项III期临床试验。
国际药讯
1.Opdivo联合Yervoy一线治疗NSCLC获欧盟批准。欧盟委员会(EC)批准百时美施贵宝纳武单抗(Opdivo)联合伊匹单抗(Yervoy)(O+Y)作为首次含铂化疗2个周期的转移性非小细胞肺癌(NSCLC)成人患者的一线治疗方案。该方案是EC批准的基于NSCLC治疗的首个双重免疫疗法,也成为继转移性黑素瘤和晚期肾细胞癌之后,在欧盟获批的以“O+Y”为基础治疗方案的第三个适应症。
2.阿斯利康BTK抑制剂Calquence获欧盟批准上市。阿斯利康(AstraZeneca)下一代BTK抑制剂Calquence(acalabrutinib)获欧盟委员会批准,用于治疗慢性淋巴细胞白血病(CLL)成人患者。此次批准是基于2项III期临床(ELEVATE-TN,ASCEND)的阳性结果。数据显示,在初治CLL患者及复发/难治性CLL患者中,与标准护理相比,Calquence显示出优越的无进展生存期和良好的耐受性。2项研究的中期结果分别发表于《柳叶刀》和《临床肿瘤学杂志》上。
3.礼来新冠中和抗体LY-CoV555获FDA紧急使用授权。FDA授予礼来(Eli Lilly)候选新冠中和抗体bamlanivimab(LY-CoV555)紧急使用授权,用于治疗轻中度COVID-19非住院患者。在一项双盲、安慰剂对照的Ⅱ期临床中,与安慰剂组相比,bamlanivimab治疗组28天内COVID-19相关住院或急诊的患者比例显著减少(3%vs10%)。该项试验结果同时表明bamlanivimab的三种剂量对病毒载量、减少住院以及安全性的影响相似。
4.杨森Darzalex皮下制剂在欧盟申请新适应症。杨森向欧洲药品管理局提交了一份II类变更申请,寻求批准扩大Darzalex(daratumumab)皮下(SC)制剂的适用范围,纳入:治疗轻链(AL)淀粉样变性患者。如果获批,Darzalex SC制剂将成为第一个治疗AL淀粉样变性的药物。Darzalex是全球首个CD38单抗,是FDA批准的首个治疗多发性骨髓瘤的单抗药物,其静脉制剂(IV)于2015年上市;其皮下制剂于今年5月、6月在美国(商品名:Darzalex Faspro)、欧盟(商品名:Darzalex SC)获批上市。
5.辉瑞/BioNTech新冠疫苗保护效力达90%。辉瑞与BioNTech公司联合开发的新冠mRNA疫苗BNT162b2在Ⅲ期临床中获积极结果。该研究已招募43538名受试者,其中38955人已经接种第二剂候选疫苗。其基于DMC评估的的中期有效性分析结果显示,与安慰剂相比,在注射BNT162b2第2剂疫苗后的第7天开始,在保护出现COVID-19症状方面达到的效率高于90%;而且无任何严重安全性问题报告。两家公司计划在11月第三周获得安全性数据后,向FDA递交紧急使用授权(EUA)申请。
6.ViiV长效HIV新药在女性中预防效果积极。ViiV Healthcare公司长效、注射型抗病毒药物卡博特韦(cabotegravir)在女性中预防HIV感染的HPTN084临床试验中获得积极中期结果。基于DSMB评估的中期分析显示,与标准口服暴露前预防(PrEP)药物相比,卡博特韦在女性中防止HIV感染的效果提高89%,两组HIV感染率分别为0.21%和1.79%。基于这一积极结果,DSMB建议试验提前揭盲。
医药热点
1.天津新增病例病毒溯源结果公布。11月8日,天津市疾控中心对本市第138例本土新冠确诊病例呼吸道标本和相关冷库环境涂抹样本,进行了新冠病毒全基因组高通量测序和序列分析。9日测序分析结果显示:与北美3至6月份流行毒株高度近似,属于L基因型欧洲家系分支II(北美分支)。目前天津已将滨海新区汉沽街、中心渔港冷链物流区A区和B区划定为中风险地区,天津市其他区风险等级不变。
2.安徽阜阳新增1例本土病例,系上海确诊病例密接者。11月10日,安徽省阜阳市颍上县确诊一例新冠肺炎病例,患者兰某系11月9日上海市通报的新冠肺炎确诊病例王某某密切接触者。11月10日零时,经专家会诊后转运至阜阳市第二人民医院隔离治疗。经县级核酸检测,省市复核,11月10日8时17分兰某被确诊为新冠肺炎病例。截至11月10日11时,已排查该病例34名密切接触者。
3.市县至少要有1家应急助产机构。近日,国家卫健委办公厅印发《关于做好妇幼保健机构秋冬季新冠肺炎疫情防控工作的通知》,要求各地在新冠肺炎定点救治医院之外,以分娩量较大的妇幼保健院、妇产医院为重点,确定一批应急助产机构,用于应急承接普通孕产妇产检和住院分娩,每个市(地、州)、每个县(市、区)确定至少1家。
股市资讯
【恒瑞医药】(1)公司收到国家药品监督管理局关于脯氨酸恒格列净片和磷酸瑞格列汀片药品的《药物临床试验批准通知书》,并将于近期开展临床试验。(2)与韩国DONG-A ST CO., LTD.公司达成协议,将具有自主知识产权的抗肿瘤药品SHR-1701(PD-L1/TGF-βRII抗体)项目有偿许可给东亚公司。
【仟源医药】子公司杭州仟源保灵药业有限公司收到国家知识产权局颁发的“富马酸卢帕他定衍生物、其制备方法及中间体和用途”发明专利证书,应用于抗过敏药富马酸卢帕他定原料药及制剂衍生物的制备及结构鉴定。
【华润双鹤】公司收到了国家药品监督管理局颁发的普瑞巴林胶囊《药品注册证书》,批准该药品生产。
审评动向
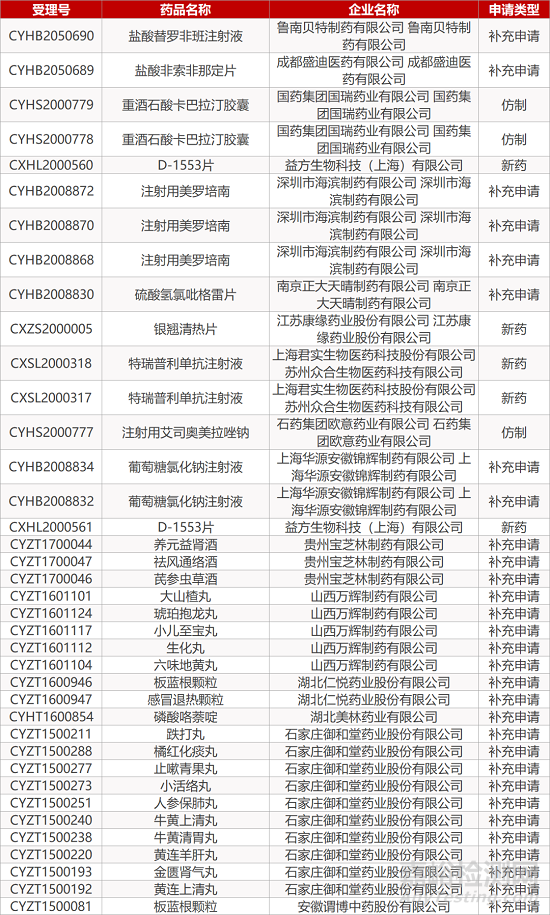
1. CDE最新受理情况(11月10日)
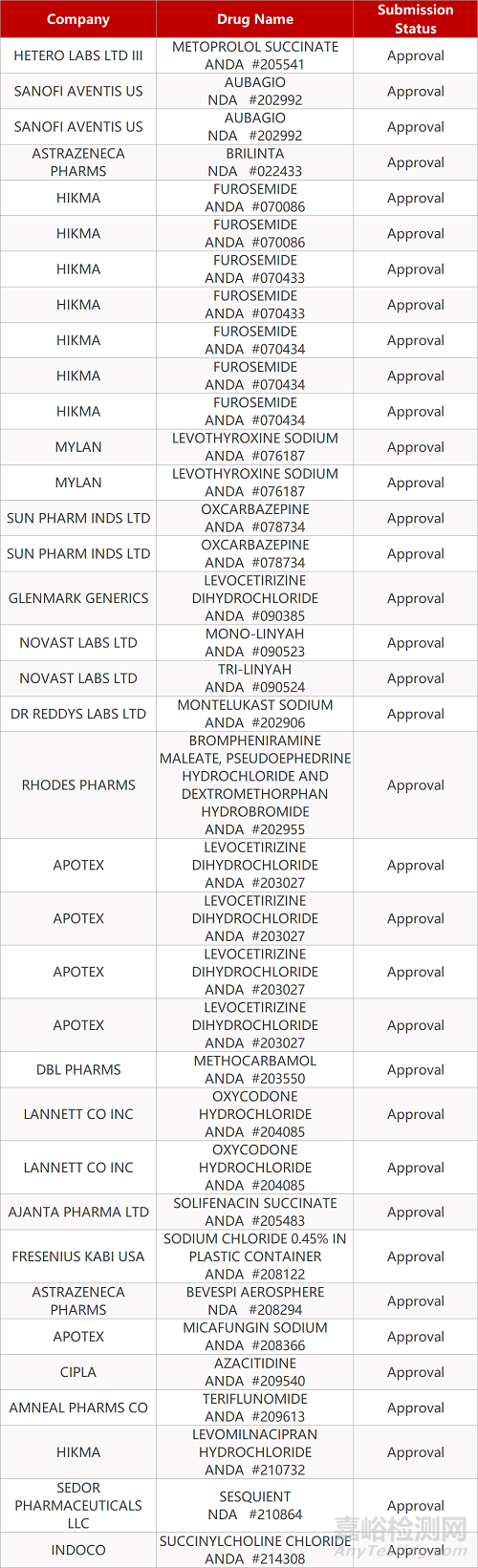
2. FDA最新获批情况(北美11月09日)
- The End -

来源:药研发


