您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-21 12:18
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
复宏汉霖曲妥珠单抗国际Ⅲ期研究结果发布。复宏汉霖在ESMO2020年会上公布其曲妥珠单抗生物类似药汉曲优®(HLX02,欧盟商品名:Zercepac®)与原研曲妥珠单抗相比一线治疗HER2阳性复发或转移性乳腺癌的Ⅲ期临床HLX02-BC01的最新数据。在意向性分析集中,HLX02组24周的总缓解率(ORRwk24)为71.3%,原研组为71.4%;在符合方案集中,HLX02组的ORRwk24为74.2%,原研组为73.2%;此外,亚组分析显示,HLX02组与原研组ORRwk24在不同人群中无统计学差异(p>0.05),达到与原研曲妥珠单抗的疗效相似性标准。
国内药讯
1.新世纪药业恩替卡韦口服溶液申报上市。安徽新世纪药业恩替卡韦口服溶液3类上市申请获CDE受理。恩替卡韦为鸟嘌呤核苷类似物,对乙肝病毒逆转录酶具有抑制作用,为乙肝一线抗病毒药物。米内网数据显示,2019年中国公立医疗机构终端恩替卡韦销售额超过70亿元,剂型有胶囊剂和片剂两种,在TOP20品牌中,正大天晴占比达48.93%;施贵宝占比为26.44%;青峰药业占比为9.52%。目前,恩替卡韦口服溶液尚无企业获批。
2.百济神州PARP抑制剂公布一项关键性Ⅱ期数据。百济神州在ESMO 2020年会上公布其PARP抑制剂帕米帕利治疗晚期卵巢癌的关键性Ⅱ期临床BGB-290-102积极数据。这项研究包括了共113例既往接受过至少两项标准化疗、携带BRCA 1/2突变的高级别上皮性卵巢癌(包括输卵管癌或原发性腹膜癌)患者,其中有90例为晚期铂敏感卵巢癌患者(队列1)和23例晚期铂耐药卵巢癌患者(队列2)。中位随访为12.2个月时,队列1中的铂敏感卵巢癌患者的客观缓解率(ORR)达到64.6%,包括8例完全缓解(CR)以及45例部分缓解(PR),中位缓解持续时间(DoR)达14.5个月,中位无进展生存期(PFS)为15.2个月。而队列2中的铂耐药患者的ORR也达到了31.6%, 包括6例PR,中位DoR为11.1个月,中位PFS为6.2个月 。
3.君实生物PD-1获FDA第3个孤儿药资格。君实生物PD-1特瑞普利单抗(拓益®)用于治疗软组织肉瘤获FDA授予的孤儿药资格。这是继黏膜黑色素瘤和鼻咽癌之后,特瑞普利单抗获得的第三个孤儿药资格。值得一提的是,就在一周前,特瑞普利单抗凭借其在鼻咽癌治疗领域已展示出的临床疗效,获得FDA授予的突破性疗法认定,成为首个获FDA突破性疗法认定的中国国产PD-1。
4.豪森药业乙肝新药拟纳入拟优先审评。豪森药业1类新药艾美酚胺替诺福韦片(HS-10234)的上市申请获CDE受理,并获纳入拟优先审评公示名单,拟用于慢性乙型肝炎成人患者的治疗。HS-10234是一款核苷逆转录酶抑制剂,豪森药业已登记了8项关于HS-10234的临床试验,其中七项针对的是慢性乙型肝炎,一项针对的是HIV感染。目前,豪森药业正在中国开展一项Ⅲ期研究,评估HS-10234片相对于替诺福韦二吡呋酯 (TDF)治疗慢性乙型肝炎患者的潜力。
5.和黄医药索凡替尼第2个NDA获受理。和黄医药索凡替尼(surufatinib)的第2个新药上市申请(NDA)获国家药监局(NMPA)受理,用于治疗晚期胰腺神经内分泌瘤。索凡替尼是一种新型口服酪氨酸激酶抑制剂,其用于治疗非胰腺神经内分泌瘤的首个NDA已于2019年11月获NMPA受理,并被纳入优先审评。该公司正在全球同步开发索凡替尼,预计将于2020年底向FDA滚动递交该产品的新药上市申请。
国际药讯
1.Seattle首创ADC结果优异提前终止Ⅲ期临床。Seattle Genetics公司与安斯泰来联合开发的抗体偶联药物Padcev(enfortumab vedotin-ejfv),在治疗既往接受过含铂化疗和PD-1/PD-L1抑制剂治疗的晚期/转移性尿路上皮癌的Ⅲ期临床中,与化疗对照组相比,显著改善了患者的总生存期,将死亡风险降低30%(p=0.001);显著改善了患者的无进展生存期,将疾病进展或死亡风险降低39%(p<0.00001)。基于这一积极中期分析结果,这一临床试验将提前终止。
2.阿斯利康/默沙东Lynparza获长期疗效数据。阿斯利康和默沙东联合开发的PARP抑制剂Lynparza(奥拉帕利),在ESMO 2020年会上公布其用于一线维持治疗携带BRCA突变卵巢癌的Ⅲ期临床SOLO-1的积极结果。5年随访数据显示,奥拉帕利将疾病进展或死亡风险降低67%(HR=0.33, 95% CI, 0.25-0.43),奥拉帕利组患者的无进展生存期达到56.0个月,而安慰剂组这一数值为13.8个月;两组疾病没有进展的患者比例分别为48.3%和20.5%,中位治疗时间分别为24.6个月和13.9个月。
3.第一三共HER3靶向ADC临床结果积极。第一三共制药在ESMO2020年会上公布其HER3靶向抗体偶联药物patritumab deruxtecan(U3-1402)在既往接受过多种前期治疗的EGFR突变、转移性或不可切除的非小细胞肺癌患者中的Ⅰ期临床积极数据。初步结果表明, patritumab deruxtecan在56例可评估患者中的客观缓解率达到25%,其中1例患者达到完全缓解,13例患者达到确认部分缓解。患者的疾病控制率为70%,中位缓解持续时间为6.9个月。
4.赛诺菲/再生元PD-1抑制剂关键性临床结果积极。赛诺菲与再生元联合开发的PD-1抑制剂Libtayo(cemiplimab)治疗晚期基底细胞癌(BCC)的关键性Ⅱ期研究结果公布在ESMO 2020年会上。试验结果表明,中位随访为15个月时,Libtayo的客观缓解率达到31%(n=84;95% CI:21%-42%);无论肿瘤细胞中PD-L1基线表达如何,都可以观察到应答;有85%获得缓解的患者缓解持续时间超过1年,中位缓解持续时间和中位总生存期尚未达到。根据Kaplan-Meier评估,无进展生存率为57%,总生存率为92%。
5.勃林格殷格翰与Mirati达成临床合作。勃林格殷格翰泛KRAS抑制剂BI1701963拟联合Mirati的KRAS G12C选择性抑制剂MRTX849开展联合用药临床研究,评估治疗携带KRAS G12C突变的实体瘤患者的潜力。临床前数据表明,KRAS G12C抑制剂与泛KRAS抑制剂BI1701963联合使用,可以增强抗肿瘤活性。BI1701963通过将KRAS平衡从激活状态移动到失活状态,可以使更多KRAS G12C突变体处于失活状态,促使它们与共价KRAS G12C抑制剂的结合。
6.阿斯利康收购下一代口服PCSK9抑制剂。阿斯利康与Dogma Therapeutics签署了一份授权协议,获得其临床前期的口服PCSK9抑制剂项目。临床前研究显示,这款口服PCSK9小分子抑制剂可以显著和大幅降低血脂异常的非人灵长类动物的LDL-C。阿斯利康拟开发该小分子药物用于治疗血脂异常和家族性高胆固醇血症,并计划于明年将其推进至人体临床试验。本次合作的财务细节尚未披露。
医药热点
1.全球制药十强格局变化预测。FiercePharma根据EvaluatePharma的预测数据,列出了一份2026年药品销售全球药企排名。根据EvaluatePharma预测,2026年,罗氏依旧稳居药品销售额榜首,总额接近620亿美元,进一步拉开与第2名辉瑞(561亿美元)的距离。从增速来看,现在起到2026年,阿斯利康与百时美施贵宝将领衔,其年均增长率预计分别达到8.47%和8.23%,销售总额预计达到410亿美元和438亿美元。而通过对艾尔建的并购,艾伯维2026年销售总额有望达到535.6亿美元,位列销售额榜单第五。
2.国家医保调整名单公示。国家医保局公布《2020年国家医保药品目录调整通过形式审查的申报药品名单》,公示期1周。共有751个药品通过形式审查,中成药178个,西药573个。其中以“2019年12月31日前,进入5个及以上省级最新版基保目录”为条件拟新增的药品达到了493个;符合“自2015年1月起获批上市的新通用名药品”条件的共有171个,囊括肿瘤、呼吸、血液、高血压、糖尿病等诸多领域。名单同时也公布15个处于协议有效期内、需重新确定支付标准的谈判药品。
3.北京减轻门诊特殊患者负担。9月18日,北京市医保局公布《关于将重性精神病门诊治疗等纳入本市基本医疗保险门诊特殊疾病范围的通知》,将重性精神病、肺动脉高压靶向治疗、耐多药结核、C型尼曼匹克病、中重度过敏性哮喘生物制剂治疗、特发性肺纤维化抗纤维化治疗6种疾病纳入医保门诊特殊疾病范围,增加恶性肿瘤门诊治疗、肾透析2种门诊特殊疾病用药报销品种,同时对罗沙司他胶囊等9种贵重药品门诊用药按固定比例支付,进一步减轻群众的用药负担。
股市资讯
【昆药集团】针对IDH1基因突变的实体瘤的选择性抑制剂KY100001片临床试验申请获得受理。
【仙琚制药】收到国家药品监督管理局下发的泼尼松龙片、氟马西尼注射液一致性评价受理通知书。
【信立泰】“重组人神经调节蛋白1-抗HER3抗体融合蛋白注射液”获得临床试验批准,申请适应症为:治疗射血分数降低的慢性心力衰竭(NYHA II-III类)。
审评动向
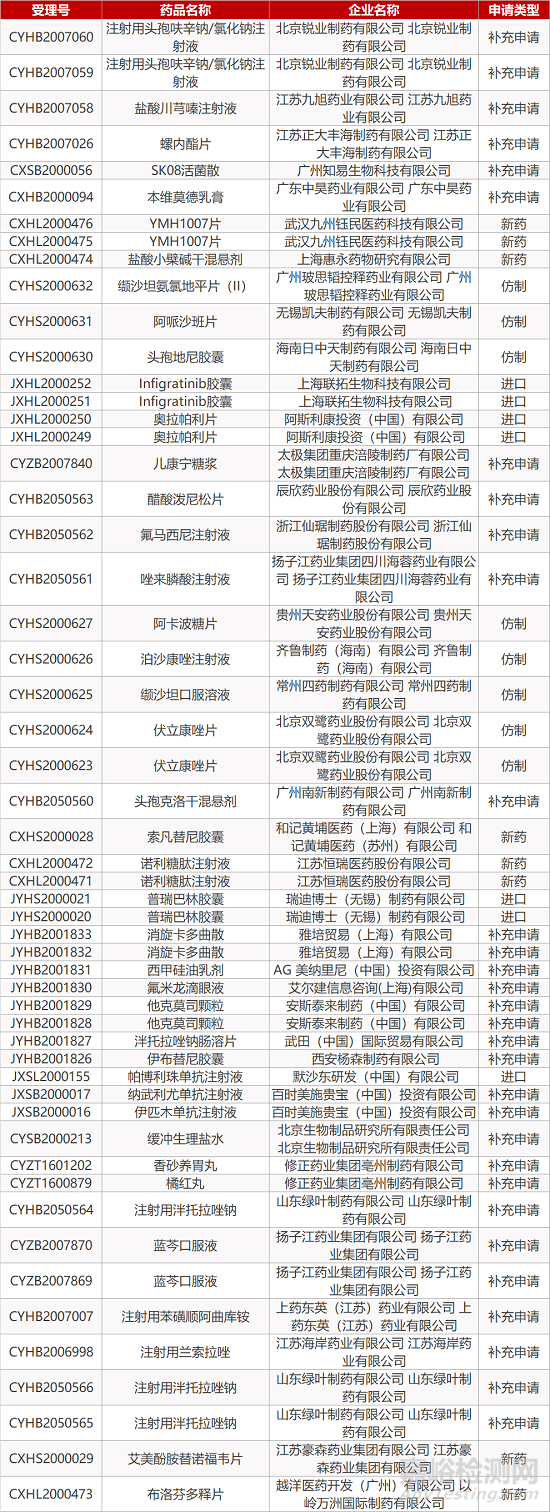
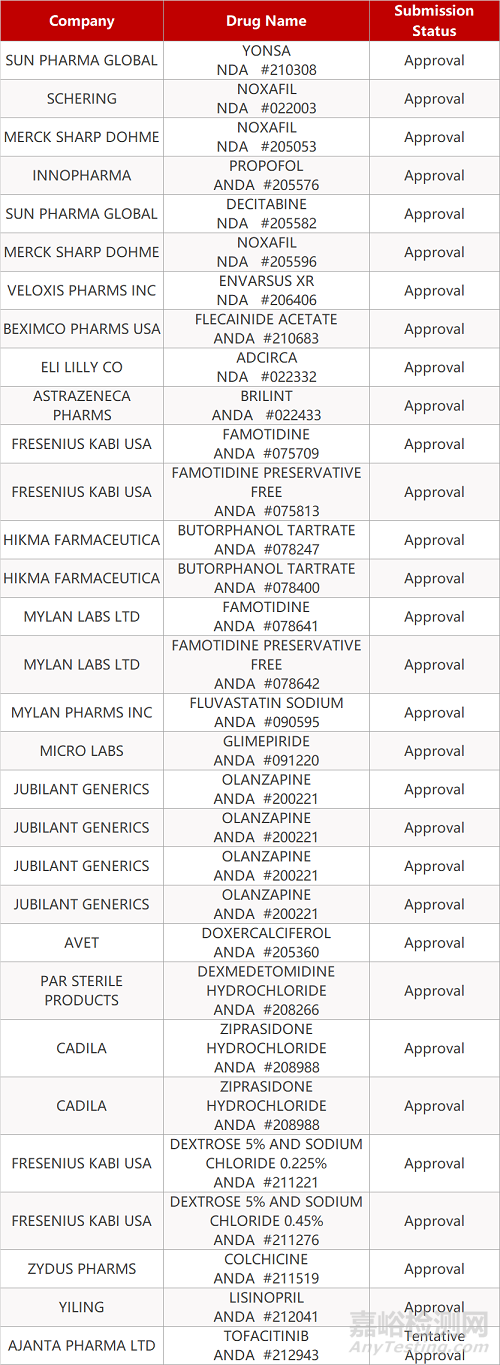
1. CDE最新受理情况(09月20日)
- The End -

来源:药研发


