您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-03 17:23
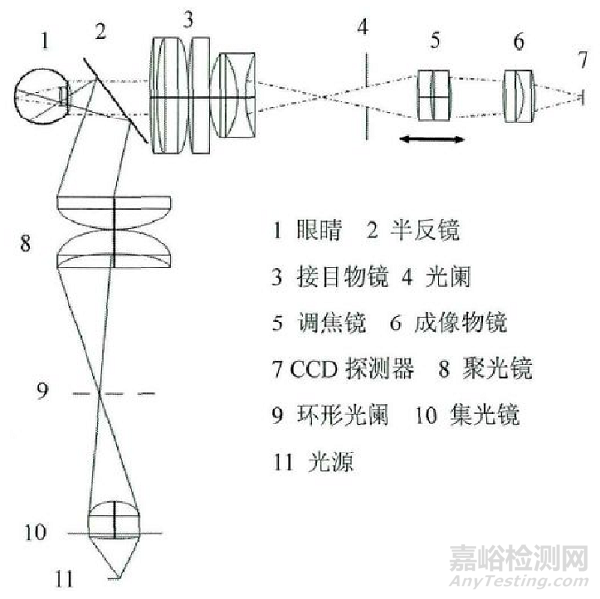
|
分类编码 |
子目录 |
一级产品类别 |
二级产品类别 |
产品描述 |
预期用途 |
品名举例 |
管理类别 |
|
2016/4/5 |
16 眼科器械 |
04 眼科测量诊断设备和器具 |
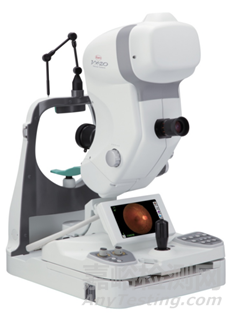
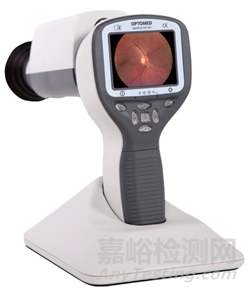
05 眼用照相机 |
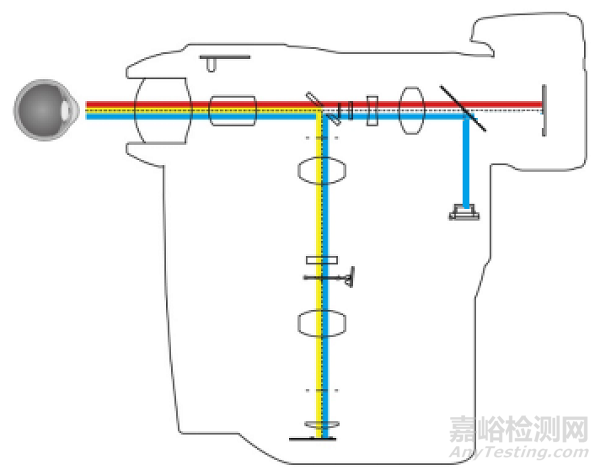
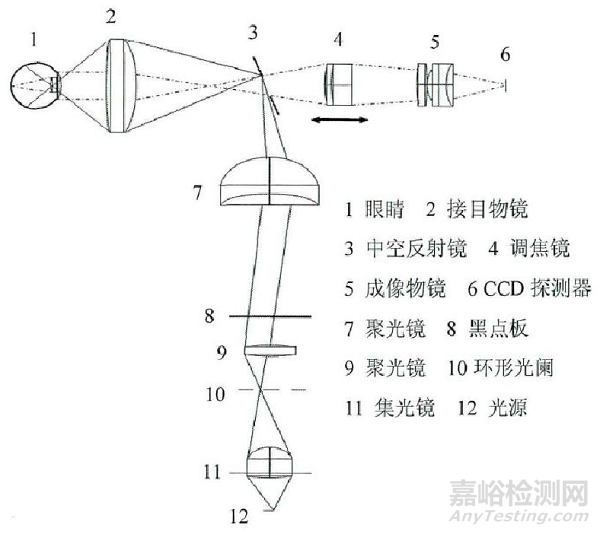
通常由照明系统、观察系统、成像系统等组成。可与单独的查看软件配合使用,并实现附加功能 |
用于拍摄眼底图像,观察和诊断视网膜病变 |
眼底照相机、数字眼底照相机、免散瞳眼底照相机、免散瞳数码眼底照相机、手持式视网膜照相机、无散瞳数码眼底照相机、手持式免散瞳眼底照相机、眼底摄影机、眼用照相机 |
II |
|
标准编号 |
标准名称 |
|
YY 0634-2008 |
眼科仪器 眼底照相机 |
|
GB 9706.1-2007 |
医用电气设备 第1部分:安全通用要求 |
|
YY 0505-2012 |
医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验 |
|
GB9706.15-2008 |
医用电气设备 第1-1部分:安全通用要求 并列标准:医用电气系统安全要求 |
|
GB7247.1-2012 |
激光产品的安全 第1部分:设备分类、要求 |
|
ISO 15004-1:2006 |
眼科仪器 基本要求和试验方法 第1部分:适用于各类眼科仪器的一般要求 |
|
ISO 15004-2:2007 |
眼科仪器 基本要求和试验方法 第2部分:光危害的防护 |
|
GB/T 191-2008 |
包装储运图示标志 |
|
GB/T 14710-2009 |
医用电气设备环境要求及试验方法 |
|
GB/T 16886.1-2011 |
医疗器械生物学评价 第1部分:风险管理过程中的评价与试验 |
|
GB/T 16886.5-2017 |
医疗器械生物学评价 第5部分:体外细胞毒性试验 |
|
GB/T 16886.10-2017 |
医疗器械生物学评价 第10部分:刺激与皮肤致敏试验 |
|
YY/T 0316—2016 |
医疗器械 风险管理对医疗器械的应用 |
|
YY/T 0466.1-2009 |
医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求 |

来源:CIRS医疗器械监管动态


