您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-03 11:24
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
信达阿达木单抗注射液即将获批上市。信达生物阿达木单抗注射液上市申请审评状态变更为「在审批」,预计即将获批成为第3款国产阿达木单抗生物类似药。阿达木单抗(修美乐)是艾伯维研发的一款人源化抗TNF-α单抗,已于2010年2月获批进口中国,目前获批成年中重度类风湿性关节炎、常规治疗效果不佳的成年中重度强直性脊柱炎和成年中重度慢性斑块状银屑病3个适应症。此外,修美乐用于治疗葡萄膜炎还被纳入第二批临床急需境外新药名单。
国内药讯
1.康希诺生物新冠疫苗进入III期临床。9月2日,康希诺生物宣布其重组新冠病毒疫苗(腺病毒5型载体)Ad5-nCoV的III期临床试验申请已获俄罗斯联邦卫生部批准,目前正在进行该项III期临床的患者入组。康希诺生物已与Petrovax公司签订协议,双方将合作推进在俄罗斯进行Ad5-nCoV的Ⅲ期临床试验。康希诺生物目前正在推动Ad5-nCoV的国际多中心III期临床试验,并计划在多个国家开展Ad5-nCoV的III期临床试验。
2.齐鲁马来酸阿法替尼片即将获批。齐鲁制药4类仿制药马来酸阿法替尼片的上市申请审评状态变更为"在审批",预计近期获批上市,有望成为继豪森药业之后第2家获批上市的药企。原研马来酸阿法替尼片(吉泰瑞)是勃林格殷格翰研发的一款酪氨酸激酶抑制剂,可以与ErbB家族受体(EGFR、HER2、ErbB3、ErbB4受体)结合,从而抑制酪氨酸激酶,抑制肿瘤生长,属于第二代EGFR-TKI。2017年3月获批进入中国,用于一线/二线治疗EGFR突变阳性的非小细胞肺癌。
3.万泰生物九价HPV疫苗III期临床启动。8月31日,万泰生物登记启动其重组人乳头瘤病毒6/11/16/18/31/33/45/52/58型九价疫苗(大肠埃希菌)一项III期临床,拟在18~45岁女性健康志愿者中评价受试疫苗中HPV 16和18型免疫原性是否非劣效于对照疫苗;评价受试疫苗与对照双价人乳头瘤病毒疫苗(大肠杆菌)相比对HPV 31、33、45、52、58型持续性感染(12个月以上)的保护性,以及对HPV31、33、45、52、58型相关CIN2及以上和/或VIN2及以上和/或VaIN2及以上病变的保护性。
4.挚盟医药新一代病毒核衣壳抑制剂申报临床。挚盟医药1类新药ZM-H1505R片的临床试验申请(IND)获CDE受理。ZM-H1505R是一款新一代病毒核衣壳抑制剂,拟用于治疗慢性乙型肝炎病毒(HBV)感染。今年1月,ZM-H1505R已在美国获得临床试验许可,目前正在美国开展一项在健康受试者中评估ZM-H1505R口服单次和多次递增剂量给药(SAD / MAD)的安全性、耐受性和药代动力学的Ⅰ期临床。这是挚盟医药成立以来在中国提交的首个IND。
5.丽珠获一款多靶点TKI药物中国权益。丽珠医药与同源康医药签署了一项《专利转让及技术独占许可协议》,丽珠医药将获得同源康医药新一代ROS1/NTRK/ALK多靶点酪氨酸激酶抑制剂(TKI)TY2136b及其相关专利在中国地区(包括香港、澳门和台湾)的独家开发及商业化权利。此笔交易的临床前研发费、首付款、里程碑付款总额达1.59亿元人民币。临床前研究表明,TY-2136b对ROS1/NTRK/ALK多个靶点均显示出优异的疗效,能有效抑制耐药基因突变,并具有一定的穿透血脑屏障能力。
国际药讯
医药热点
1.健康中国行动试考核将开展。9月1日,健康中国行动推进委员会办公室印发了《推进实施健康中国行动2020年工作计划》。《计划》提出,研究制定健康中国行动监测和考核细则,组织开展健康中国行动2019年度试考核,形成试考核评价报告,并修订完善考核细则。《计划》将推动15个专项行动落实年度计划,明确各专项行动重点任务。在健康知识普及行动方面,《计划》拟研究医疗卫生机构和医务人员开展健康促进与教育的绩效考核机制。
2.北京调整重大防疫措施。9月2日,针对北京恢复直航问题,北京市新冠病毒肺炎疫情防控工作领导小组宣布重大防疫措施调整。原则上对入境人员集中观察14天,并进行两次核酸检测;集中观察期满后,核酸检测为呈阴性的,出具核酸检测阴性证明和解除集中观察证明;确诊病例治愈出院后,实施14天集中隔离观察,核酸检测阴性并无其它症状后解除隔离;解除集中隔离后,对返回北京社区(村)的,将需要继续进行7天健康监测。
3.国家卫健委新设五个国家儿童区域医疗中心。9月2日,国家卫健委发布《国家卫生健康委关于设置国家儿童区域医疗中心的通知》,决定分别在东北区域以中国医科大学附属盛京医院为主体,在华东区域以浙江大学医学院附属儿童医院为主体,在中南区域以广州市妇女儿童医疗中心为主体,在西北区域以西安交通大学附属儿童医院为主体,在西南区域以重庆医科大学附属儿童医院为主体联合四川大学华西第二医院共设置五个国家儿童区域医疗中心。
股市资讯
【透景生命】公司取得上海市药监局颁发的4项医疗器械注册证,均为第二类体外诊断试剂;4项试剂盒分别是用甲基试卤灵底物法测定脂肪酶和用化学发光免疫法测定肌红蛋白、心型脂肪酸结合蛋白、肌酸激酶MB同工酶。
【迪瑞医疗】公司获得“一种用于吸样容器的托盘自动锁紧装置”的专利证书,能够实现耗材托盘的自动锁紧与分离,优化工作流程和提高效率。
【白云山】全资子公司中一药业和广西盈康共计34个药品收到广东、广西药监局签发的再注册批准通知书。
审评动向
1. CDE最新受理情况(09月02日)
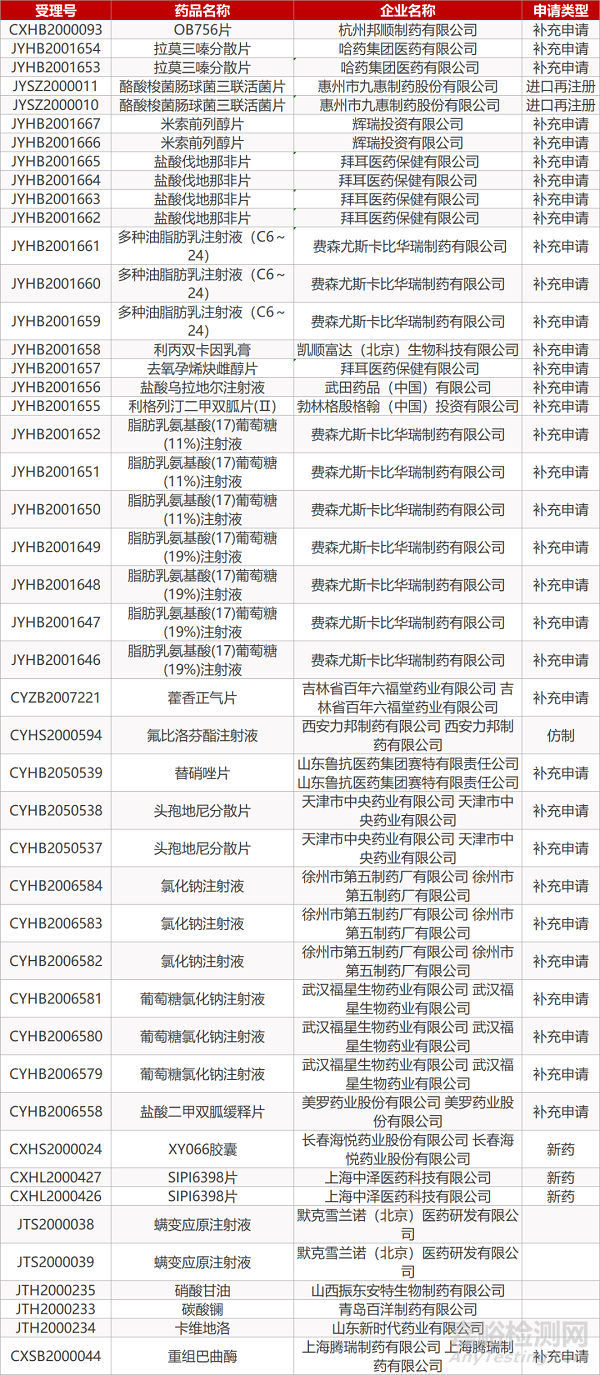
2. FDA最新获批情况(北美09月01日)
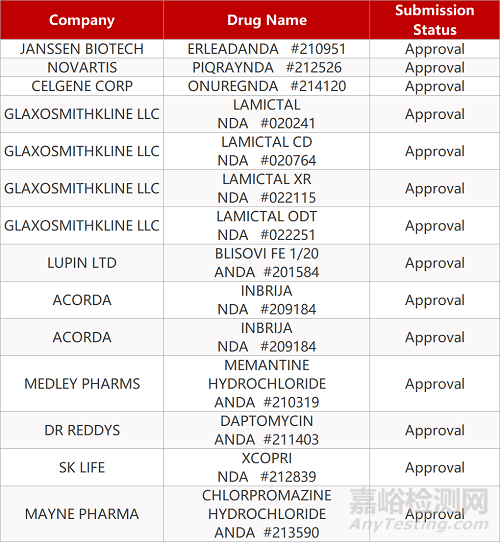

来源:药研发


