您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-08-06 09:11
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
中国首个“突破性疗法”花落南京传奇。8月5日,南京传奇生物的LCAR-B38M CAR-T细胞自体回输制剂(简称:LCAR-B38M细胞制剂)获CDE纳入拟突破性疗法认定公示名单。值得一提的是,这是中国首个获CDE拟授予突破性疗法的产品。这款药物已先后获得了FDA授予的突破性疗法认定和EMA授予的优先药物资格,用于既往接受过一种蛋白激酶抑制剂、一种免疫调节剂、一种CD38抗体治疗并且最后一次治疗后复发时间不超过12个月的复发难治性多发性骨髓瘤。
国内药讯
1.康辰药业地拉罗司分散片上市申请获受理。康辰药业4类仿制药地拉罗司分散片上市申请获CDE受理。地拉罗司(Deferasirox)是一种口服铁螯合剂,原研产品为诺华的恩瑞格(Exjade),主要用于治疗2岁及以上因输血导致的慢性铁过载患者,以及10岁以上非输血依赖性地中海贫血患者的慢性铁过载治疗。该品种属于《第一批鼓励仿制药品目录》药品,目前原研产品已获批进口国内,康辰药业是第2家仿制药申报上市。
2.天境生物伊坦生长激素Ⅲ期注册临床申请获受理。天境生物长效重组人源生长激素(rhGH)伊坦生长激素(eftansomatropin,TJ101)用于治疗儿童生长激素缺乏症的Ⅲ期注册临床试验申请获CDE受理。该研究拟入组大约165名受试者,评估伊坦生长激素治疗的安全性、疗效和药代动力学,并证明与阳性对照药物诺泽®重组人生长激素注射液相比较的非劣效性。伊坦生长激素由韩国Genexine公司开发,天境生物拥有其在中国地区开发、生产和商业化的权益。
3.润新生物1类创新药脑胶质瘤Ⅱ期临床首例患者给药。润新生物在研Na+/K+-ATP酶抑制剂RX108治疗复发胶质母细胞瘤的Ⅱ期临床于复旦大学附属华山医院完成首例患者给药。这是一项单臂、开放、多中心的Ⅱ期研究,旨在评价RX108在经标准治疗后出现进展或复发的胶质母细胞瘤患者的有效性和安全性。RX108具有“一靶多点”的作用机制,目前正在中国和美国开展针对不同实体瘤的多项临床研究。
4.葛兰素史克ICOS受体激动剂国内申报新临床。葛兰素史克ICOS受体激动剂GSK3359609注射液在国内提交的新的临床申请获CDE受理。GSK3359609是一款新型IgG4单抗,在激活ICOS受体的同时不导致体内T细胞的衰竭,具有进一步激活T细胞并提高免疫检查点抑制剂疗效的潜力。目前全球尚无同靶点药物获批,GSK3359609处于全球III期临床阶段,是同类药物中开发进度最快的在研新药。GSK3359609此前已在中国获批两项临床研究:一项为联合PD-1帕博利珠单抗治疗头颈部鳞癌,另一项为治疗复发/难治性实体瘤类恶性肿瘤。
5.天士力与Takara公司终止溶瘤病毒产品合作协议。8月4日,天士力发布公告称其与日本Takara公司(日本宝生物工程株式会社)协商一致,决定终止有关治疗胰腺癌及黑色素瘤的溶瘤病毒产品(C-REV)的相关合作并于日前签署了终止协议。C-REV是Takara研发的一种HSV-1减毒菌株,天士力于2020年5月获得C-REV在中国开发、注册、生产和商业化的不可撤销和排他性的权益及依照开发计划在合作区域内获得批准之需,在北美和欧洲国家进行临床试验的不可撤销和非排他性权益。截至该公告日,就该项目天士力尚未发生任何款项的支付,未在国内开展临床前研究,未发生研发投入。
国际药讯
1.CymaBay公司PPARδ激动剂Ⅲ期试验达主要终点。CymaBay Therapeutics在研PPARδ激动剂seladelpar在治疗原发性胆管炎(PBC)的Ⅲ期试验(ENHANCE)中获积极结果。在10mg seladelpar组和5mg seladelpar组中,分别有78.2%和57.1%的患者达到了主要的复合终点,而安慰剂组这一比例仅为12.5%,具统计学意义的显著改善。seladelpar显示出抗胆汁淤积、抗炎和止痒的功效。此前,seladelpar已获FDA和欧盟EMA授予治疗PBC的罕见病药物称号,并获得EMA授予治疗PBC的优先药物资格。
2.再生元中和抗体“鸡尾酒”疗法动物实验结果发表。再生元在预印本网站bioRxiv上发布了其新冠病毒中和抗体“鸡尾酒”疗法REGN-CoV2,预防和治疗新冠病毒感染的最新动物试验结果。在恒河猴和金仓鼠两种动物模型中,REGN-CoV2除了在动物感染新冠病毒之后能够迅速提高病毒的清除速度以外,作为预防性疗法提前注射,也能够为动物提高保护能力,显著加快随后攻毒实验时病毒的清除速度。7月初,REGN-CoV2已在Ⅰ期临床中已表现出良好的安全性特征,目前评估REGN-CoV2预防和治疗新冠病毒感染的两项Ⅲ期临床正在进行当中。
3.Novavax重组新冠佐剂疫苗Ⅰ期临床结果积极。Novavax公司重组COVID-19佐剂疫苗NVX CoV2373在Ⅰ期临床中获积极数据。2次接种后100%的受试者产生了中和抗体应答,而且低剂量5 µg疫苗产生的中和抗体平均几何滴度(GMT)达到3900左右,是COVID-19恢复期患者的4倍;NVX CoV2373同时能诱导抗原特异性多功能CD4阳性T细胞应答,免疫应答强烈偏向Th1表型(IFN-γ、IL-2和TNF-α)。该公司计划9月底开展一项全球性Ⅲ期临床,检验这一疫苗预防COVID-19的效果。
4.诺华CAR-T疗法治疗滤泡性淋巴瘤结果积极。诺华CAR-T细胞疗法Kymriah(tisagenlecleucel)在治疗复发/难治(R/R)滤泡性淋巴瘤(FL)患者的Ⅱ期临床ELARA中获积极结果。中期分析显示,Kymriah达到了独立审查委员会评估的完全缓解率(CRR)的主要终点。详细结果将在医学会议上公布,并将纳入美国和欧盟监管申请资料中。Kymriah是FDA批准的首个靶向CD19的CAR-T细胞疗法,已获批用于治疗R/R急性淋巴细胞白血病(ALL),以及R/R弥漫性大B细胞淋巴瘤(DLBCL)。
5.默沙东获NASH新药Efinopegdutide独家许可。默沙东和韩美(Hanmi Pharmaceutical)就韩美公司的在研GLP-1/GCGR双重激动剂efinopegdutide(HM12525A)的开发、生产和商业化达成了一项独家许可协议。该新药拟用于治疗非酒精性脂肪性肝炎(NASH),目前处于Ⅱ期临床开发阶段。根据协议,默沙东将获得efinopegdutide在美国和全球开发和推广的独家许可;韩美将获1000万美元的前期付款,高达8.6亿美元里程碑付款以及产品销售额的分成。韩美保留efinopegdutide在韩国商业化的选择权。
6.阿斯利康获新型抗纤维化疗法RXC006独家权益。英国生物制药公司Redx Pharma与阿斯利康签署了Wnt信号通路porcupine蛋白抑制剂RXC006的全球独家权利转让协议。阿斯利康将拥有RXC006针对特发性肺纤维化(IPF)等纤维化疾病的开发与商业化的独家授权。根据协议,阿斯利康将在Ⅰ期临床成功之前支付早期里程碑付款1700万美金。Redx还有资格从阿斯利康再获得高达3.6亿美金的开发、监管和商业化里程碑付款,以及产品净销售额5%左右的分层特许权使用费。
医药热点
1.武汉30个重点监控品种开启议价采购。武汉市药械联采办公布《重点监控合理用药议价药品目录》,并发布《武汉市2020年重点监控合理用药药品议价实施细则》。重点监控议价目录涉及30个药品,其中20个为国家重点监控药品目录中的品种,另外10个品种为谷红注射液、参芎注射液、鹿瓜多肽注射液、胎盘多肽注射液、红花黄色素注射液、丙氨酰谷氨酰胺、核黄素磷酸钠、转化糖、木糖醇、注射用血栓通等。《实施细则》明确最高限价(有效报价)为本企业品种省级挂网最低价的0.7倍。
2.2020年度国家科技奖初评结果出炉。国家科学技术奖励工作办公室正式公布了2020年度国家科学技术奖的初评结果。本年度初评通过46项国家自然科学奖项目、47项国家技术发明奖通用项目、133项国家科学技术进步奖通用项目。专用项目另行公布。医药领域方面,有31个项目通过初评。其中,钟南山呼吸疾病防控创新团队通过了2020年度国家科技进步奖初评,并建议被授奖。
3.哈佛大学:美国13州应立即“封城”。哈佛大学全球卫生研究所和埃德蒙德·萨夫拉伦理中心联合明尼苏达大学传染病研究与政策中心、乔治敦大学全球健康科学与安全中心等机构,共同提出名为“归零之路”的国家抗疫方针,建议美国政府通过更可靠的接触者跟踪、检测和隔离等措施扼制病毒传播。研究团队将美国各地划分为红、橙、黄、绿4个风险等级,如过去7天平均每10万人每天新增病例超过25例为红色,10—25例之间为橙色,1—10例之间为黄色,小于1例为绿色。根据上述标准,佛罗里达等13个州为红色风险,应立即封城。
股市资讯
【恒瑞医药】公司及子公司苏州盛迪亚生物医药有限公司、上海恒瑞医药有限公司的产品SHR-1316注射液获国家药监局核准签发的《药物临床试验批准通知书》,并将于近期开展临床试验。
【步长制药】全资子公司山东丹红制药有限公司研制的“重组抗肿瘤坏死因子-α(TNF-α)全人源单克隆抗体注射液”获得伦理审查批件,正式开展Ⅲ期临床试验。
【人福医药】公司拟以3.62亿元将所持四川人福70%股权转让给重药集团。
审评动向
1. CDE最新受理情况(08月05日)
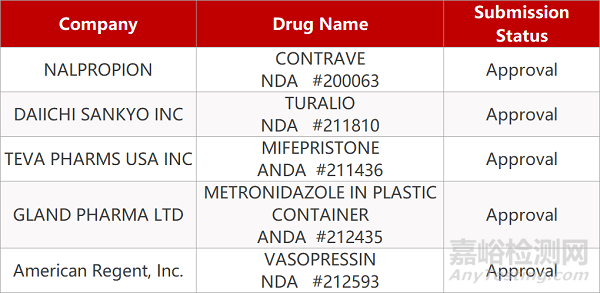
2. FDA最新获批情况(北美08月04日)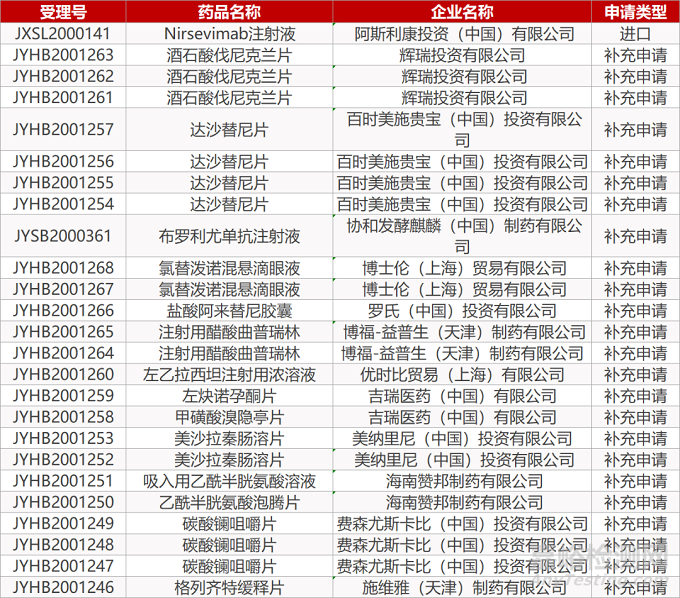
- The End -

来源:药研发


