您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-27 10:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
印度法匹拉韦仿制药治疗COVID-19患者结果积极。印度制药公司Glenmark抗病毒药物FabiFlu(法匹拉韦favipiravir的仿制药),在一项Ⅲ期临床中加快了轻中度COVID-19患者恢复健康的周期。与安慰剂相比,favipiravir将病毒清除率增加28.6%,达到主要终点;favipiravir治疗组在第4天达到临床治愈的患者比例为69.8%,与对照组的44.9%相比具有统计学意义;在需要氧气支持的患者中,favipiravir治疗的患者开始首次使用氧气的平均时间为5天,而安慰剂组为2天;临床中Favipiravir耐受性良好,无严重不良事件或死亡报告。
国内药讯
1.石药盐酸度洛西汀肠溶胶囊获批。7月24日,石药集团4类仿制药盐酸度洛西汀肠溶胶囊获国家药监局批准上市,成为继倍特药业之后国内第2家该药品通过一致性评价的产品。度洛西汀是礼来开发的一种选择性5-羟色胺(5-HT)和去甲肾上腺素(NE)再摄取抑制药。临床用于治疗抑郁症。原研产品2006年8月在中国获批,商品名为欣百达,其2019年销售额为7.25亿美元。该品种获批的国内厂家有恩华药业、上药中西制药等。
2.京新药业盐酸普拉克索缓释片首家获批。7月24日,京新药业4类仿制药盐酸普拉克索缓释片获国家药监局批准上市,单独(无左旋多巴)或与左旋多巴联用,用于治疗特发性帕金森病的体征和症状。普拉克索原研厂家为勃林格殷格翰,于1997年7月获FDA批准上市,2005年4月获批进入中国。京新药业和石药集团开发的盐酸普拉克索片此前已在中国获批,后者已率先通过一致性评价。盐酸普拉克索缓释片目前只有原研厂家在中国获批销售。
3.基石药业PD-1抗体获FDA孤儿药资格。基石药业宣布FDA已授予其PD-1抗体CS1003孤儿药资格,用于治疗肝细胞癌。CS1003是基石药业自主研发的一种靶向人程序性细胞死亡蛋白1(PD-1)的人源化重组IgG4单克隆抗体,是基石药业肿瘤免疫骨架产品之一,目前已开展了多项联合治疗的临床研究,其中CS1003联合乐伐替尼一线治疗晚期肝癌患者的全球多中心Ⅲ期注册临床研究正在入组。
4.派格生物长效GLP-1受体激动剂PB-119启动III期临床。7月23日,派格生物1类创新药物—长效GLP-1受体激动剂PB-119「聚乙二醇艾塞那肽注射液」启动一项III期临床,评价PB-119一线治疗2型糖尿病(T2D)的安全性和有效性。在中国和美国已完成的四项I期临床结果显示:PB-119在研究剂量范围内不仅安全性耐受性良好,且较低剂量组即已展现出平稳有效控制血糖水平的优势。目前PB-119已在中美同步启动III期临床,其中,国内包括两个适应症,二甲双胍单药治疗血糖控制不佳的T2D,以及初治的T2D。
5.罗氏Tecentriq治疗三阴性乳腺癌在华开启同情用药。罗氏在药物临床试验登记与信息公示平台官网登记一项《阿替利珠单抗(Atezolizumab)一线治疗三阴性乳腺癌患者拓展性同情使用方案》。Atezolizumab(Tecentriq)目前已在中国获批小细胞肺癌的适应症,肝细胞癌适应症申请正在审评中,三阴性乳腺癌适应症尚未在中国获批。该研究旨在为中国急需的三阴性乳腺癌患者提供Atezolizumab治疗并收集安全性数据。参加机构为重庆医科大学附属第一医院。
6.尚健生物CD38单抗申报临床。尚健生物1类新药CD38单抗临床试验申请获CDE受理。CD38分子是单链Ⅱ型跨膜糖蛋白,广泛表达于造血细胞及非造血细胞系。近年来,CD38抗体在成人多发性骨髓瘤(MM)的治疗已获得了明显的疗效和良好的安全性。目前,全球已有两款CD38抗体获批上市,其中强生旗下杨森的达雷妥尤单抗已于去年在中国获批,由赛诺菲开发的isatuximab也于近日在华获批临床。另外,天境生物引进的CD38抗体正在中国开展Ⅱ期临床。
国际药讯
1.FDA加速批准第三款CAR-T细胞疗法上市。吉利德旗下Kite Pharma宣布,FDA已加速批准其靶向CD19的自体CAR-T疗法Tecartus(KTE-X19)上市,用于治疗复发/难治性套细胞淋巴瘤(MCL)成人患者。这是这类患者首款获批的CAR-T疗法。在一项正在进行的关键性临床ZUMA-2中,Tecartus在60例可评估的复发/难治性MCL患者中单次输注产生应答的患者比率为87%,其中完全缓解率达62%。在首次出现客观缓解后6个月的随访时,患者尚未达到中位缓解持续时间。
2.JAK抑制剂治疗特定GVHD达Ⅲ期临床终点。Incyte公司与诺华联合开发的JAK1/2抑制剂Jakafi(ruxolitinib),在治疗中重度类固醇难治性或依赖性慢性移植物抗宿主病(GVHD)患者的Ⅲ期临床中达主要终点,与最佳可用疗法相比,第24周的总缓解率更优。该研究还达到两个关键性次要终点,显著改善无失败生存期(FFS)和根据mLSS症状量表评估的患者报告症状。详细数据将于医学大会上公布。两家公司计划近期提交其上市申请。
3.UCB银屑病创新疗法达到Ⅲ期临床终点。优时比公司在研IL-17A/F抑制剂bimekizumab在治疗中重度斑块状银屑病的Ⅲb期临床BE RADIANT中获积极结果。与活性对照IL-17A抑制剂相比,bimekizumab在第16周达PASI 100(银屑病面积和严重程度指数100%改善)应答的患者比率更高,达主要终点指标;同时,Bimekizumab在第4周达到PASI 75和第48周完全清除皮肤症状方面优于活性对照组,达所有重要次要终点。这是这款IL-17A/F在第四项Ⅲ期临床试验中获得积极结果。
4.创新心肌病靶向疗法获FDA突破性疗法认定。MyoKardia公司口服心肌肌球蛋白变构调节剂mavacamten获FDA授予突破性疗法认定,用于治疗症状性、梗阻性肥厚型心肌病(HCM)。在一项Ⅲ期临床中,与安慰剂相比,mavacamten使患者实现了运动能力变化(VO2峰值)的改善,以及纽约心脏协会功能等级(NYHA)的改善,达主要研究终点指标;在所有次要终点上,mavacamten也显示了具有统计学意义的改善。MyoKardia计划于2021年第一季度在美国提交mavacamten的新药申请。
5.G1再次授权lerociclib许可权益。肿瘤学公司G1 Therapeutics与EQRx公司就G1公司的CDK4/6抑制剂lerociclib签订一项许可协议。Lerociclib已开发用于与某些类型的乳腺癌和肺癌中与其他靶向疗法联合使用。根据协议,EQRx获得了lerociclib在美国、欧洲、日本和所有其他全球市场[不包含亚太地区(日本除外)]的专有权;G1将获得2000万美元的前期现金付款,可能金额2.9亿美元的开发和商业里程碑付款以及产品销售分成。据悉,这是今年G1就lerociclib执行的第三次战略合作。
医药热点
1.美国23个州暴发沙门氏菌疫情 数百人感染。美国《国会山报》25日消息称,美国疾控中心(CDC)正在调查波及23个州的沙门氏菌暴发事件,目前已有数百人感染,尚无死亡病例。感染沙门氏菌的症状包括腹痛、腹泻、发烧,致命的可能性很低。免疫系统较弱的人、5岁以下儿童和65岁以上的成年人更容易出现严重病症,沙门氏菌症状可能需要2到4周的时间才能显现。目前,沙门氏菌菌株的具体来源尚不明确。
2.医师未经培训合格不得授予抗菌药处方权。国家卫健委发布《关于持续做好抗菌药物临床应用管理工作的通知》,明确医师未经本机构培训并考核合格,不得授予抗菌药物处方权。医院不得单纯依据医师职称授予相应处方权限。《通知》要求,二级以上综合医院设立感染性疾病科,并在2020年年底前设立以收治细菌真菌感染为主要疾病的感染病区或医疗组。医疗机构要做好使用新上市抗菌药物、联合使用抗菌药物及出现抗菌药物多重耐药病例的会诊工作。
3.全面推开公立医院薪酬制度改革。国务院办公厅日前印发《深化医药卫生体制改革2020年下半年重点工作任务》,共包括加强公共卫生体系建设、深入实施健康中国行动、深化公立医院综合改革、深化医疗保障制度改革、健全药品供应保障体系和统筹推进相关重点改革六个部分。其中在深化公立医院综合改革方面指出,全面推开公立医院薪酬制度改革,指导地方完善公立医院薪酬总量核定、内部绩效考核和收入分配办法,建立健全医疗卫生机构保障与激励相结合的运行机制。
股市资讯
【科伦药业】公司近日获得国家药监局核签的药品“盐酸伐地那非片”和“奥氮平片”的《药品注册证书》。
【国药一致】国大药房已成功摘牌成大方圆100%股权转让项目,成交价格为人民币18.6亿元,并签署了《产权交易合同》.
【新产业】公司全自动化学发光新型冠状病毒棘突蛋白受体结合区IgG抗体检测试剂盒取得了CE认证。
审评动向
1. CDE最新受理情况(07月26日)
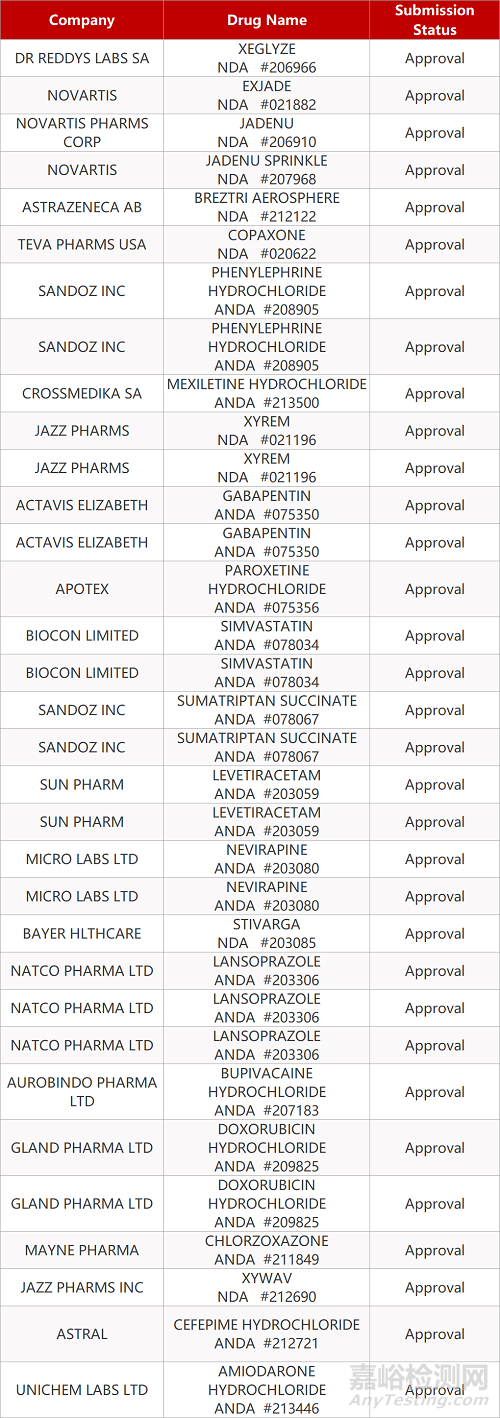
2. FDA最新获批情况(北美07月24日)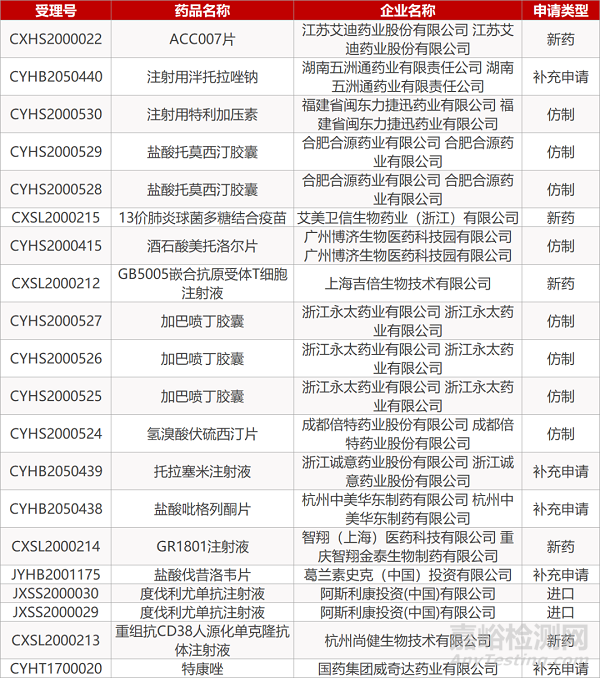
- The End -

来源:药研发


