您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-01-03 10:51
《ISO 14971 医疗器械-风险管理对医疗器械的应用》标准自2016年启动升版,经过三年的讨论和修订,最终的版本于2019年12月发布。本次修订是在2000版和2007版的基础上,进行的第三版的修订。第三版的修订,是由ISO/TC 210和IEC/SC 62A技术委员会联合进行,这是在2016年对ISO 14971标准进行系统的评估的基础上,以及着眼更严格的法规要求而进行的。ISO 14971的姊妹篇ISO/TR 24971也在同步修订,预计会在2020年发布。
ISO 14971下载地址http://www.anytesting.com/data/q-14971.html
十大主要变化
基于ISO 14971:2019前言(Foreword)部分
变化1
按照ISO/IEC指令(Clause 15 of ISO/IEC Directives, Part 2:2018)的架构要求,增加了第二章节引用标准(Normative references),但实际的第三版的ISO 14971:2019并没有引用任何标准。
变化2
更新了相关定义,并且采用了ISO/IEC Guide 63:2019里面新的定义,并且相关定义在标准中用斜体印刷。比如:
伴随文件(accompanying documentation)的定义,用Material取代了document,并在注解2指明伴随文件并不单指书面的或者印刷的文件,还包括声音、视觉、触觉和多媒体等形式的文件形式。在注解1中列举伴随文件包括说明书(instructions for use)、技术说明(technical description)、安装手册(installation manual)、快速使用指南(quick reference guide)等
危害(Harm)定义去掉了物理的(Physical),使得危害的定义比原来更加广泛。
变化3
新增加三个定义:
受益(Benefit):使用医疗器械对个人健康的正面影响或期望的结果, 或对患者管理或公共健康的正面影响。
备注:受益可以包括对临床结果的正面影响、病人的生活质量、诊断有关的结果、与诊断器械对临床结果或公共卫生的正面影响
合理可预见的误用(reasonably foreseeable misuse):没有按照制造商的预期使用一个产品或者系统,但这些结果是根据人类行为可以容易预测的。
现有技术水平(state of the art ):根据相关科学、技术和经验的综合考虑,在特定时间内对产品、工艺和服务开发所应达到的技术能力水平。备注:现有技术水平体现了当前和普遍接受的技术和医学的良好实践。现有技术并不一定意味着是最先进的技术和解决方案。这里描述的现有技术水平有时被称为“普遍公认的技术水平”。
变化4
更加关注使用医疗设备所带来的“受益”。“受益-风险分析”与有些法规的术语保持一致(比如欧盟的MDR和IVDR)。
变化5
澄清ISO 14971:2019规定的流程可以用于管理与医疗器械相关的风险,包括数据和系统安全的风险。
变化6
综合剩余风险的评价方法和接受准则需要在风险管理计划中确定。该方法可以包括收集和评审该医疗器械、市场上同类器械和同类的其它产品的数据和文献。对综合剩余风险的接受准则可不同于单个风险接受的准则。
变化7
在对综合剩余风险进行评估和判断可接受后,将单个剩余风险的告知移入到综合剩余风险的告知的要求(条款8)。
变化8
医疗器械上市前,必须要评审风险管理计划的执行情况。评审的结果必须在包括在风险管理报告中。
变化9
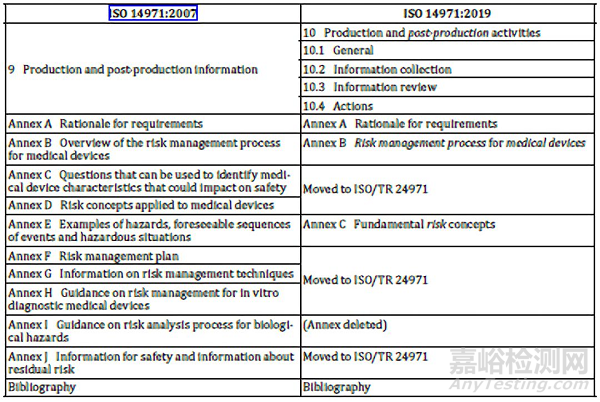
生产和生产后信息的条款进行了澄清和重新调整,对信息的收集和针对安全相关信息所采取的措施的要求进行了细化。
变化10
几个参考的附录将转移动ISO/TR 24971,ISO/TR 24971也在同步修订。ISO 14971第三版修订的理由和标准要求的解释在附录A里面有描述。附录B增加了第二版和第三版的条文对照表,见如下:



来源:Internet


