您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-10-21 08:56
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
FDA发布2019财年仿制药审批报告:1171项批准创纪录。FDA近日发布2019财年(2018年10月-2019年9月)仿制药批准情况公告。2019财年仿制药获批数量创下新纪录,共批准1171项仿制药,比2018年971项仿制药批准的历史最高记录还要高。其中935项为完全批准,236项为临时批准。在这1171项的批准中,有125项是“首次批准”的仿制药。除了用于阿片类药物过量的紧急治疗药--纳洛酮盐酸盐鼻喷剂(Narcan)的首仿产品外,2019年FDA还批准了用于治疗肺动脉高压、乳腺癌、癫痫、抑郁症和感染性疾病的多种药物。
国内药讯
1.汇宇制药注射用替莫唑胺申报上市。汇宇制药按仿制药3类申报上市的注射用替莫唑胺获国家药监局受理。替莫唑胺是一种咪唑并四嗪类具有抗肿瘤活性的烷化剂,可用于治疗新诊断的多形性胶质母细胞瘤成人患者,也可用于治疗难治性间变性星形细胞瘤成人患者。该产品最早由英国阿斯顿大学研制,后由德国先灵葆雅制药获得全球绝大部分市场的唯一开发权,并先后上市胶囊剂和注射剂两种剂型。国内该品种注射剂获批的厂家目前仅有恒瑞医药。
2.贝达药业恩沙替尼临床研究成果发布。贝达药业新一代间变性淋巴瘤激酶(ALK)抑制剂盐酸恩沙替尼治疗ALK阳性非小细胞肺癌的Ⅱ期临床结果积极。其研究显示,恩沙替尼对克唑替尼耐药的ALK阳性NSCLC患者具有良好的疗效和安全性。独立评审委员会评估的ORR为52.6%,疾病控制率为87.8%,中位PFS为11.2个月,颅内ORR为71.4%,颅内病灶控制率达95.2%,显示出良好的持续性结果。详细结果发表在《柳叶刀•呼吸医学》(The Lancet Respiratory Medicine)上。目前该药的上市申请已被国家药监局纳入优先审评,全球Ⅲ期临床也正在推进中。
3.复星医药HLX55单抗获NMPA临床批件。复星医药注射用HLX55单抗获国家药监局临床批件。HLX55单抗为复星集团获Kolltan Pharmaceuticals, Inc.许可、并后续自主研发的创新型治疗用生物制品,主要用于转移性或复发性实体瘤的治疗。目前该新药用于无其他标准治疗的晚期实体瘤治疗已获台湾地区“卫生福利部”临床试验批准。全球范围内尚无该新药的同类产品获批上市。HLX55是一款针对c-MET靶点开发的人源化单克隆抗体。临床前研究结果表明,靶向HGF/c-MET(天然配体肝细胞生长因子/c-MET)信号通路的HLX55在体内外具有抗肿瘤作用和良好的安全性,这些数据为后续开展人体临床试验提供了科学基础。
4.奥赛康引进一款1类抗菌新药。奥赛康药业与中国医学科学院医药生物技术研究所签订《技术开发合同》,共同开发一款1类创新药物AL0912。中国医学科学院医药生物技术研究所开发的AL0912对临床严重耐药的革兰氏阴性菌具有广谱活性,多项体内外药效研究显示抗菌活性强于多粘菌素B和E,并且毒性降低,目前正在进行IND申请相关的临床前研究。根据协议,奥赛康药业将获该项目在全球的临床开发、注册、生产和市场销售的独家权利。2018年中国公立医疗机构终端多粘菌素B注射剂销售额超过2亿元,目前国内厂家仅有上药第一生化药业的同类产品获批。
5.上海莱士2019年前三季度业绩预告。上海莱士披露2019年前三季度业绩预告,预计净利润6.00亿-6.20亿元,同比增长146.41%-147.96%,第三季度净利润盈利1.87亿-2.07亿元,而在去年前三季度亏损12.93亿元,全年亏损15.18亿元。对于扭亏为盈,上海莱士表示,主要是2019年血液制品行业发展势头良好,公司的战略聚焦于血液制品主营业务及生物制品相关产业,今年前三季度血液制品销售收入同比增长较大;同时,公司逐步退出投资业务,风险投资规模已较去年同期大幅缩减。
6.原力生命科学完成A轮融资。原力生命科学完成1.26亿元人民币A轮融资。此轮融资由礼来亚洲基金领投,天使轮投资方德屹资本跟投。原力生命科学是一家以抗肿瘤药物研发为核心的创新型生物医药公司,其创始人、董事长兼首席执行官孙勇奎博士于2016年当选为美国国家工程院院士,曾供职于默沙东20余年,拥有非常丰富的新药研发与商务拓展经验。此轮融资将推动原力临床前项目向临床阶段的转化,并将持续推进该公司的研发管线。
国际药讯
1.基因泰克流感新药Xofluza获批扩展适应症。罗氏(Roche)旗下基因泰克抗流感新药Xofluza(baloxavir marboxil)获FDA批准扩大适应症,用于治疗12岁及以上流感并发症高风险人群(发生感染不超过48小时且尚无并发症发生)。一项Ⅲ期试验CAPSTONE-2结果显示,在流感并发症高风险患者中,Xofluza显著延缓流感症状出现的中位时间(102小时比73小时);Xofluza与奥司他韦相比,对流感症状的持续时间具有类似的疗效(54小时比54小时);对于B型病毒,Xofluza比安慰剂改善流感症状用时更短(75小时比101小时);此外Xofluza显示出良好的耐受性和安全性。Xofluza是一种首创的、单剂量口服药物,具有抑制聚合酶酸性核酸内切酶(一种病毒复制所必需的酶)的新颖作用机制。
2.FDA批准首款外用米诺环素疗法。Foamix Pharmaceuticals开发的4%米诺环素外用泡沫制剂Amzeeq(minocycline)获FDA批准,用于治疗非结节性中重度痤疮患者的炎症性病变(成年和9岁以上儿科患者)。这是首款获FDA批准的外用米诺环素疗法。在3项Ⅲ期临床中,与载体对照组相比,Amzeeq显著降低患者的炎症性病变数目,显著提高IGA(研究者总体评估)评分达到0或1(意味着皮肤症状完全清除或接近完全清除),或IGA比基线提高至少2分的患者比例。Amzeeq预计在2020年一月上市。
3.益普生Cabometyx在加拿大获批一线治疗aRCC。益普生(ipsen)公司靶向抗癌药Cabometyx(cabozantinib)片剂获加拿大卫生部批准一线治疗晚期肾细胞癌(aRCC)成人患者。一项II期研究CABOSUN结果显示,与舒尼替尼相比,Cabometyx显著延长初治的中、高危aRCC患者的无进展生存期(中位PFS:8.6个月 vs 5.3个月),使疾病进展或死亡风险显著降低52%(HR=0.48,p=0.0008)。Cabometyx在美国和欧盟此前已获批用于治疗既往接受血管内皮生长因子(VEGF)靶向疗法治疗失败的aRCC患者。2017年12月和今年5月,Cabometyx分别在美国和欧盟获批用于中高危aRCC的一线治疗。
4.全球首款埃博拉病毒疫苗欧盟即将获批。默沙东埃博拉疫苗Ervebo(V920)获欧洲药品管理局(EMA)人用医药产品委员会(CHMP)推荐条件性批准,用于预防18岁及以上人群因埃博拉病毒引起的疾病。Ervebo有望成为全球首款获批的埃博拉病毒疫苗。发表于《柳叶刀》上的一项研究显示,与其它埃博拉疫苗的预防效果只能保持在6个月左右相比,Ervebo可以将预防效果维持达到两年。Ervebo此前已获FDA授予突破性疗法认定和优先审评资格,预计明年3月14日前作出回复。
5.优时比IL-17A/F双重抑制剂达到Ⅲ期临床终点。优时比靶向IL-17A和IL-17F的双重抑制剂bimekizumab,在治疗中重度慢性斑块型银屑病的Ⅲ期临床中结果积极。该研究旨在比较bimekizumab与另一款已上市的IL-12/IL-23抑制剂ustekinumab的疗效。结果显示,bimekizumab治疗组的患者银屑病面积和严重指数评分下降超过90%(PASI 90),且皮肤症状完全或接近清除(PGA评分0或1)的患者比例显著高于活性对照组;Bimekizumab治疗组达到PASI 100和PGA 0评分的患者比例也显著高于安慰剂组。
6.阿斯利康/第一三共ADC药物获优先审评资格。阿斯利康(AstraZeneca)与第一三共(Daiichi Sankyo)联合开发的抗体偶联药物(ADC)trastuzumab deruxtecan(DS-8201)的上市申请获FDA受理,用于治疗HER2阳性转移性乳腺癌。FDA同时授予其优先审评资格。一项Ⅰ期临床结果表明,在接受过HER2抗体疗法pertuzumab、trastuzuma以及靶向HER2的ADC疗法ado-trastuzumab emtansine治疗的HER2阳性患者中,DS-8201能够达到59.5%的客观缓解率和93.7%的疾病控制率。已完成的Ⅱ期临床中DS-8201也达主要临床终点。目前,DS-8201有5项关键性试验正在进行中,治疗的患者群包括表达HER2的胃癌患者,HER2表达低的转移性乳腺癌患者,表达HER2的晚期结直肠癌和非小细胞肺癌患者等。
医药热点
1.流感疫苗接种技术指南更新。中国疾控中心发布《中国流感疫苗预防接种技术指南(2019~2020)》。《指南》推荐6月龄~5岁儿童、60岁及以上老年人、慢性病患者、医务人员、6月龄以下婴儿的家庭成员及看护人员、孕妇或准备在流感季节怀孕的女性为优先接种对象,6月龄(含)以上且无禁忌证的人群均可接种流感疫苗。此外,《指南》在4个方面进行了更新:增加了新的研究证据、增加了一年来国家卫健委流感防控有关政策和措施、更新了2019~2020年度国内批准上市及批签发的流感疫苗种类以及更新了本年度三价和四价流感疫苗组份。
2.确保贫困人口纳入三项制度保障。国家医保局等多部门发布《关于坚决完成医疗保障脱贫攻坚硬任务的指导意见》。明确各地要将确保贫困人口全部纳入基本医疗保险、大病保险和医疗救助三项制度保障范围作为医疗保障脱贫攻坚硬任务。进一步加强三重制度综合保障功能。全面建立统一的城乡居民医保制度,稳定住院待遇预期,完善门诊统筹;普惠性提高大病保险保障水平,对贫困人口继续执行起付线降低50%、支付比例提高5个百分点的倾斜政策,并全面取消建档立卡贫困人口封顶线;医疗救助资金继续向深度贫困地区倾斜,进一步提高医疗救助托底保障能力。
3.赛诺菲解散波立维销售及医学团队。据第一财经报道,赛诺菲(中国)已在解散波立维的医学团队以及销售团队。赛诺菲在集采扩围中两个品种拟中选,其中波立维75mg以2.544元/片的报价,甚至低于4+7中选厂家信立泰(降幅近20%),最终获得中选资格,与石药集团、乐普药业三家共同瓜分氯吡格雷公立医院70%的存量市场,采购周期至少2年。此前,赛诺菲(中国)公共事务及市场准入副总裁钱云曾接受相关媒体采访时表示,根据政府未来对带量采购扩面的政策导向与有效实施,赛诺菲将谨慎评估业务模式。
【英科医疗】拟在越南投资1.4亿美元(含注册资本)建设年产88.2亿只(882万箱)高端医用手套及其他医疗耗材项目,项目总体规划及占地面积180亩左右,建设周期为29个月。
审评动向
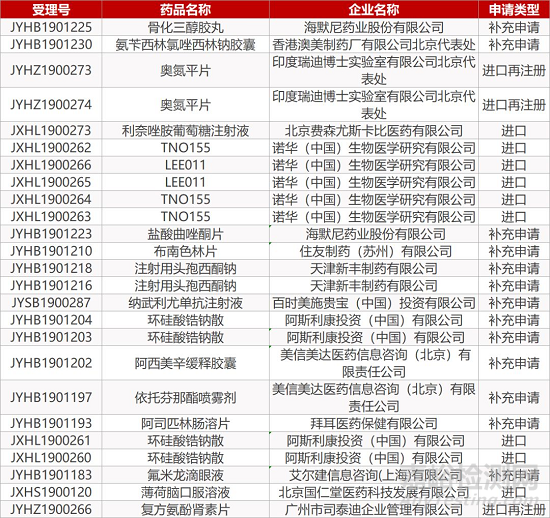
1. CDE最新受理情况(10月20日)
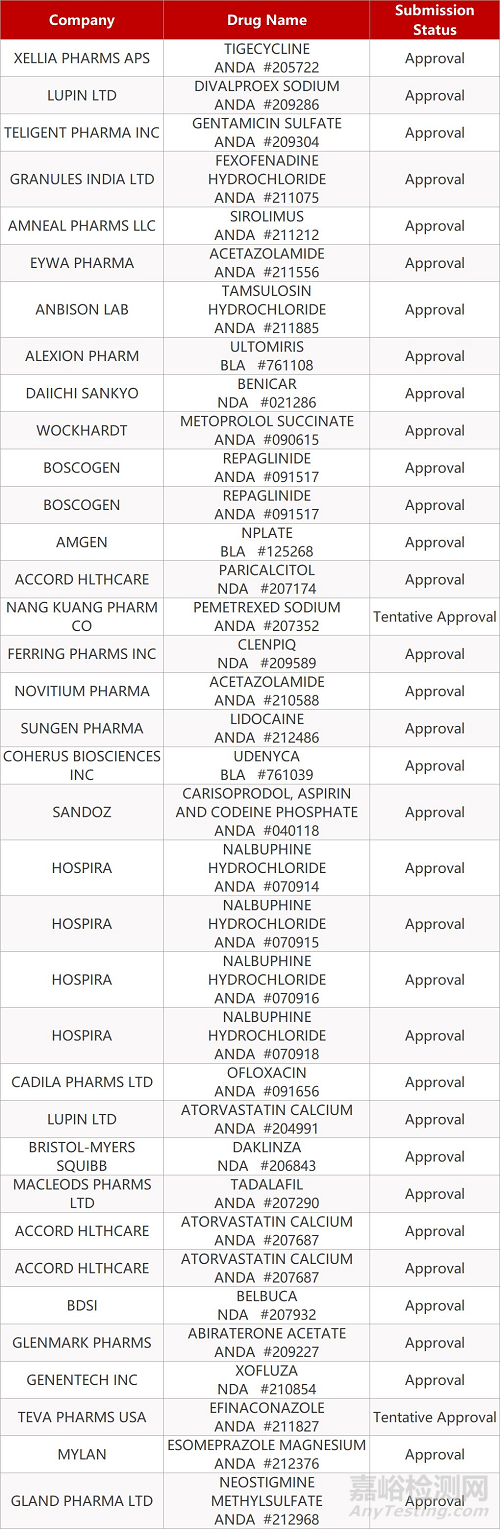
2. FDA最新获批情况(北美10月119日)

来源:未知


