您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-06-06 14:01
一、元素杂质分类
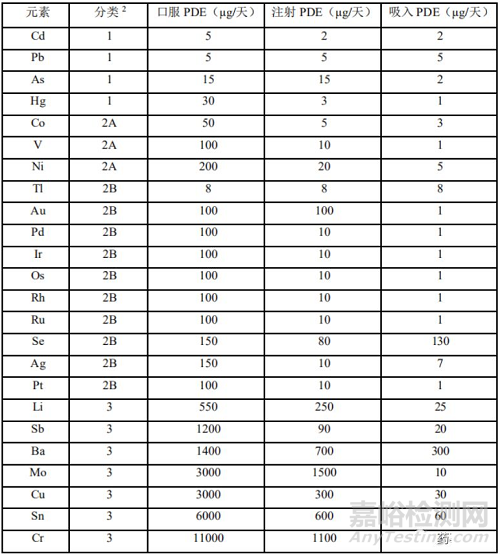
PDE,即每日允许暴露量,以为µg/day为单位。ICHQ3D列出了各个元素杂质的PDE。具体见下表1。同时根据元素的毒性(PDE 值)及其在药品中出现的可能性,ICH指南将元素杂质分为 3 类。但不包括有些元素杂质的 PDE 值还未建的其他元素杂质。
分类 1:元素砷(As)、铬(Cd)、汞(Hg)和 铅(Pb)是人体毒素,在药品生产中禁用或限制使用。这4种元素在所有元素杂质的潜在来源以及给药途径的风险评估中都应进行评估。风险评估的结果将确定那些可能需要额外的控制的组分,在某些情况下额外的控制可能包括对分类 1 中元素进行检测。并不是所有成分都需要检测分类 1 中的元素杂质,仅当风险评估确定需要进行恰当的控制以确保满足 PDE 值时才实施检测。
分类 2:这类元素通常被认为是给药途径依赖型的人体毒素。基于它们出现于药品中的相对可能性,可进一步分成 2A 和 2B 亚类。
a. 分类 2A 元素出现在药品中的相对可能性较高,需包含所有元素杂质的潜在来源以及给药途径(标明的)的风险评估。分类 2A 的元素杂质包括: Co、Ni 和 V。
b. 分类 2B 元素丰度较低以及与其它物料潜在共生的可能性较低,其出现在药品中的概率较低。除非这些元素在原料药、辅料或其它药品成分的生产中有意添加,否则无需进行风险评估。分类 2B 的元素杂质包括: Ag、Au、Ir、Os、Pd、Pt、Rh、Ru、Se 和 Tl。
分类 3:此类元素口服给药途径的毒性相对较低(高 PDE 值,通常>500µg/天),但在吸入和注射给药途径中的风险评估中仍需考虑。除非这些元素是有意添加,否则无需在风险评估中予以考虑。对于注射和吸入给药产品,在风险评估过程中应对含有此类元素杂质的可能性进行评估,除非给药途径的特定 PDE 值高于 500µg/天。此类元素包括: Ba、Cr、Cu、Li、Mo、Sb 和 Sn。
其它元素:由于固有毒性低和/或区域监管的差异性,有些元素杂质的 PDE 值还未建立,应遵从适用于特定元素的其它指导原则和/或地方法规和规范(如:铝导致肾功能损害、锰和锌导致肝功能损伤)或药物制剂的质量考虑(如:存在于治疗性蛋白中的杂质钨)。部分经过考虑的元素包括:Al、B、Ca、Fe、K、Mg、Mn、Na、W 和 Zn。
表1 各元素杂质分类及PDE值
二、限度控制方法
1、方法 1:药品日摄入量不超过 10 克的药品组分中元素的通用允许浓度限值:
适用于日服用剂量不超过10g的药品。该方法假设药品的日服用剂量为 10g ,且在风险评估中已鉴定的元素杂质(目标元素)存在于药品的所有成分中。采用下面公式计算出各个元素杂质浓度。若在风险评估中,如果药品中所有成分确定的目标元素均未超出方法1的浓度,则所有 这些成分都可以任何比例在该药品中使用。
浓度(μg/g) =PDE(μg / day) ÷日服用剂量(g / day)
例1:以一种口服固体药品为例,该药每日最大摄入量为 2.5g,含有 4 种组分(1 种原料药和 3种辅料,见表1-1)。本药品未超过 10g 的最大日摄入量,故可采用方法1计算的浓度。若每个组分中的金属元素含量均没有超过 PDE 的限度。则药品中每一元素杂质都不会超过 PDE 的限度。
表1-1 药品中每种组分的日最大摄入量
|
组分 |
日摄入量/g |
|
原料药 |
0.2 |
|
辅料1 |
1.5 |
|
辅料2 |
0.5 |
|
辅料3 |
0.3 |
2、方法 2a:明确药品组分中元素每日摄入量的通用允许浓度限值:
此方法与方法 1 类似,除了日服用量使用实际日最大服用量来计算每个元素的通用允许浓度。 基于实际日摄入量,此方法对每个目标元素在药品的每个组分中确定一个以μg/g表示的通用最大浓度的固定值。在风险评估中,如果药品中所有成分确定的目标元素均未超出方法 2a 的浓度,则所有这些成分都可以任何比例在该药品中使用。
例2:仍以例1为例,以一种口服固体药品为例,该药每日最大摄入量为 2.5g,含有 4 种组分(1种原料药和 3种辅料,见表1-1)。假设经过评估,铅、 砷、
镉、汞需要评估,则按照每日最大摄入量为2.5g分别计算的元素杂质的限度。具体数值见下表2-1。
表2-1 元素杂质限度
|
组分 |
最大允许浓度(µg/g) |
|||
|
铅 |
砷 |
镉 |
汞 |
|
|
原料药 |
2 |
6 |
2 |
12 |
|
辅料1 |
2 |
6 |
2 |
12 |
|
辅料2 |
2 |
6 |
2 |
12 |
|
辅料3 |
2 |
6 |
2 |
12 |
若各种辅料中的金属元素最大允许浓度均未超过上表限度,则药物中的金属元素浓度不会超过限度。
3、方法 2b:明确药品单一组分中元素每日摄入量的通用允许浓度限值:
分别加和制剂中各组分元素的杂质量。如果风险评估已经确定某个特定的元素不是某个具体组分的潜在杂质,则无需给出该元素在该组分中的定量结果。该方法允许某元素在药品的某些特定组分中的最大允许浓度高于方法 1 或方法 2a 的限度,但需要由在药品其它组分中更低的允许浓度进行补偿。公式可用来表示每种元素在组成药品的每种组分中的特异性限度,以保证满足 PDE 值。
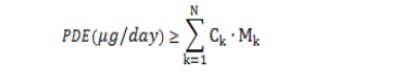
k= 药品中 N 种成份指数;
CK= 成份 k 中元素杂质的允许浓(µg/g)
Mk= 在药品日最大摄入量时成份 k 的质量 2
例3:以一种口服固体药品为例,该药每日最大摄入量为 2.5g,含有 4 种组分(1 种原料药和 3种辅料),各组分日摄入量见下表。各组分中辅料2及辅料3的铅浓度µg/g超过表2-1中铅的最大允许浓度2µg/g。通过下表计算,药物总的PDE为4.01µg/day,小于ICH规定的5µg/day的规定,故药品铅含量符合规定。
表3-1 元素杂质限度
|
组分 |
日摄入量/g |
铅浓度µg/g |
PDE µg/day |
|
原料药 |
0.2 |
1.5 |
0.3 |
|
辅料1 |
1.5 |
1.2 |
1.8 |
|
辅料2 |
0.5 |
2.5 |
1.25 |
|
辅料3 |
0.3 |
2.2 |
0.66 |
|
实际药品中铅PDE µg/day |
4.01 |
||
|
ICH规定铅PDE µg/day |
5 |
||
4、方法 3:成品分析:药物终产品中每种元素浓度是可以测定的。公式 1 可用来以药品最大总日剂量计算某个元素杂质的最大允许浓度。
三、元素杂质水平高于既有 PDE 值可以接受的情况
针对元素杂质水平高于既有 PDE 值(表1)是可以接受的的特殊情况,ICH列了以下几种情况,但明确不限于以下情况:
1、间隔给药;
2、短期给药(比如:30 天或更短);
3、特殊适应症(比如:危及生命的、未满足的医疗需求、罕见病)。
四、元素形态
所谓元素形态,即一种元素的不同物种在特定体系种的分布情况。每种元素杂质都有可能以不同的氧化或配位态存在。例如,砷的毒性表现主要是以无机砷的形式存在,而汞的毒性主要以甲基汞的形式存在,其他形式或价态砷、汞的毒性较弱或无毒。但这些元素的限度是基于毒性最强的形态进行控制的,而元素的测定是通过总量(包括各种形态)来控制的。当测定的元素总量超过限度时,可以测定不同形态的元素杂质。
五、元素杂质控制流程
1、风险评估
通过风险评估来确定需要考虑的元素杂质。需要从有意添加及潜在元素杂质识别两方面进行。同时影响药品种潜在元素杂质水平的因素也需要在风险评估中考虑,这些因素包括但不限于:在后续工艺过程中清除元素杂质的有效性、元素天然丰度(对于非人为引入的元素尤为重要)、对于特定来源的元素杂质浓度范围的先验知识、制剂的组成等。
a. 有意添加元素:在原料药、辅料或其它药品成分的生产过程中有意添加元素(如催化剂)的残留杂质。
b. 潜在元素杂质识别:
l 非有意添加且潜在存在于药品生产所用原料药、水或辅料中的元素杂质。
l 由生产设备潜在引入到原料药和/或制剂中的元素杂质。
l 由容器密封系统潜在浸出至原料药和制剂的元素杂质。
2、分析方法开发及验证
对风险评估确定的元素的分析方法进行开发及验证,关于这块的内容,笔者之前有发表过类似文章,在此就不累赘的描述了。
3、检测及控制策略的制定
根据风险评估及相关的检测来确定元素杂质水平。可通过3 批代表性生产规模或 6 批中试规模的组分或药品数据,用以建立元素杂质的水平。若该杂质水平小于控制阈(即30%PDE值)可以通过跳检等形式控制,对于大于控制阈但小于限度的元素杂质,可通过日常常规检测的形式进行控制,当然也可以从工艺等各方面进行调整来降低元素杂质水平。针对大于限度的元素杂质,那必须从各个方面进行控制,保证该元素杂质在限度范围内。
参考资料
ICH3D元素杂质
USP<232>
USP<233>
USP<1225>
USP<730>

来源:药事纵横


