您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-03-11 14:32
3月6日,国务院发布了《关于取消和下放一批行政许可事项的决定》国发〔2019〕6号,取消25项行政许可事项,下放6项行政许可事项的管理层级。具体来看,取消的25项行政许可包括:国产药品注册初审、假肢和矫形器(辅助器具)生产装配企业资格认定、新兽药临床试验审批等。
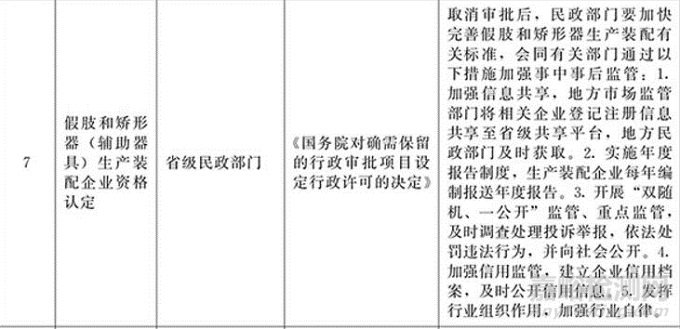
其中,假肢和矫形器(辅助器具)生产装配企业资格认定:取消审批后,民政部门要加快完善假肢和矫形器生产装配有关标准,会同有关部门通过以下措施加强事中事后监管:
加强信息共享,地方市场监管部门将相关企业登记注册信息共享至升级共享平台,地方民政部门及时获取。
实施年度报告制度,生产装配企业每年编制报送年度报告。
开展“双随机、一公开”监管、重点监管,及时调查处理投诉举报,依法处罚违法行为,并向社会公开。
加强信息监管,建立企业信用档案,及时公开信用信息。
发挥行业组织作用,加强行业自律。
其中,取消国产药品注册初审,就是说,今后国产药品在进行注册申报时,无需再走省级药监部门的初审环节,改由国家药监局直接受理国产药品的注册申请。这无疑是我国优化药品注册审评审批流程的又一重大措施。

此前,中国政府多次要求并出台政策加快药品注册审批,满足患者急需。3月6日,国务院总理李克强来到广西代表团参加审议政府工作报告时也表示,要深化“放管服”改革,加强教育、医疗、养老等领域薄弱环节建设。药品注册初审的取消无疑会提高我国药品审评审批的效率,加快新药及仿制药的上市时间。
根据要求,国家药监局需通过以下措施优化服务、加强监管:1.优化工作流程、完善工作标准,做好直接受理工作。2.提高药品注册审评人员的专业能力,用最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责,严格实施技术审评和审批,把牢药品注册上市关口,切实加强药品安全监管。

来源:AnyTesting


