您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2019-01-17 17:33
原国家食品药品监督管理总局(以下简称“总局”)于2014 年12 月29 日出台《医疗器械生产质量管理规范》(2014年第64 号)[1],规定《医疗器械生产质量管理规范》自2015年3 月1 日起施行;同年发布《关于医疗器械生产质量管理规范执行有关事宜的通告》(2014 年第15 号),通告规定自2016年1月1日起,所有第三类医疗器械生产企业应当符合医疗器械生产质量管理规范的要求[2];2015 年9 月1 日起,《药品医疗器械飞行检查办法》[3] 实施,《食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知》(食药监械监[2015]218 号)[4] 也于同年9 月25 日发布。自此,奠定了医疗器械生产企业质量管理体系检查基础。2017 年,总局针对境内外97 家生产企业组织了飞行检查,笔者希望通过总局网站上的检查结果分析整理,籍此提取一些有意义、有价值的参考信息,以便读者参阅。
1.2017年度总局境内外医疗器械飞行检查基本情况
收集汇总2017 年度总局网站发布的境外医疗器械现场检查和境内医疗器械飞行检查的检查结果见表1。
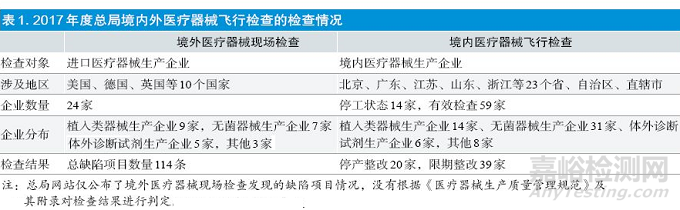
境内生产企业平均每家企业缺陷项目数量达11.86 条,在单个企业发现的缺陷项目总数最多者有30 条,被要求停产整改的企业数量达20 家;而境外生产企业平均每家企业缺陷项目数量仅4.75 条,其中发现缺陷项目数量最多的企业PRODIMED为14 条。
由于境外医疗器械现场检查的24 家生产企业为St. JudeMedical Cardiac Rhythm Management Division、Covidien llc、泰尔茂株式会社、3M Health Care等生产质量管理体系较成熟的企业,所以境外医疗器械现场检查的汇总结果仅提供参考,不能代表境外生产企业的普遍情况。但境内飞行检查中被要求停产整改的企业占有效检查企业的比例高达33.90%,包括5 家植入类器械生产企业、12 家无菌器械生产企业、1家体外诊断试剂生产企业和2 家普通器械生产企业,这是需要引起境内生产企业警惕的。
2.缺陷项目分布情况
境内外检查结果的缺陷项目在《医疗器械生产质量管理规范》及其附录的分布趋势基本一致,主要分布在厂房与设施、设备、文件管理、采购、生产管理、质量控制等章节。但缺陷项目在各章节的发生概率略有区别,在境外生产企业主要集中在文件管理、质量控制和生产管理部分,而在境内生产企业则在厂房与设施、质量控制和生产管理部分。见表2。
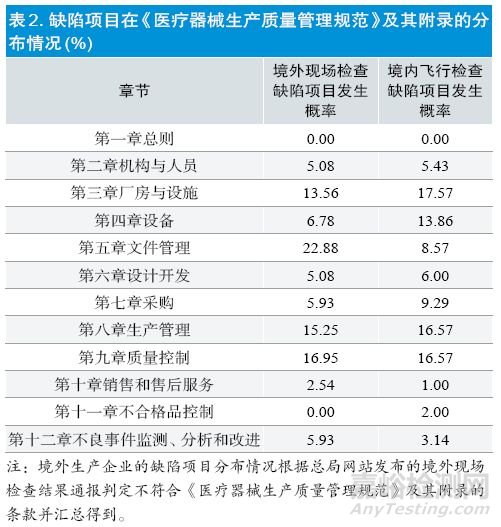
另外也收集汇总了飞行检查中重复出现概率较高的缺陷项目。出现概率>3%的缺陷项目列举如下:境内生产企业,第十七条、第二十条、第二十五条、第二十七条、第五十条、第五十七条;境外生产企业,第十五条、第十七条、第二十四条、第二十五条、第二十七条、第五十七条、第五十八条。
3.主要问题分析
通过对收集的缺陷项目汇总分析,发现一些常见问题在境内外生产企业的生产质量管理体系中仍然非常触目,如:仓储区缺少温湿度、避光控制措施,无法保证物料的贮存条件符合要求;原材料、包装材料、中间品、产品等不按区域划分的要求摆放;程序文件和记录未按照流程审批生效发放,废止文件被使用或引用;记录有随意涂改现象,且无签注姓名和日期;检验仪器设备未检定或校准,存在校准时选取的测量值与实际使用的值不一致的情况。
同时,境内外生产企业各自的短板具有差异。其中,境外企业:①有三分之一的被检查企业存在对中国法规、标准的识别和理解明显不足的问题;②产品检测操作规范与产品技术要求不一致;③抽样数量与标准或程序文件规范不符。境内企业:①设备管理欠缺,如设备的状态标识存在缺失、混乱的情况,设备使用、清洁、维护和维修的记录缺失或不实,记录内容不完整;②生产记录不对称,如领取量与使用量、生产数量和入库数量、入库数量与出库数量等;③生产记录不完整,缺少产品名称、规格型号、原材料批号、生产批号或产品编号、生产日期、数量、主要设备、工艺参数、操作人员等内容。
4.结论
笔者对总局2017 年度境内外医疗器械飞行检查结果进行了汇总分析。根据分析结果,生产企业仍需从人、机、料、法、环、测各方面入手,查漏补缺,保证质量管理体系的持续、高效运行,特别在厂房与设施、设备、文件管理、采购、生产管理、质量控制方面需要持之以恒地真抓实干;监管机构的日常监督检查也可参照缺陷项目的分布情况划重点,持续关注重点问题。
对过往飞行检查结果的汇总分析是生产企业针对生产质量管理体系进行查漏补缺、防范未然的有效手段,同时也为监管机构有目的性和针对性的科学监管提供数据支撑。
作者:王军 王越 包世勇(浙江省医疗器械审评中心)

来源:中国医疗器械信息


