您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2018-08-23 18:45
近日,药监局公布6家医疗器械企业召回质量问题产品,具体情况如下:

Philips Medical Systems DMC GmbH对移动式摄影X射线机主动召回
飞利浦(中国)投资有限公司报告,由于存在某些情况下可能出现手指被夹住的潜在问题,生产商Philips Medical Systems DMC GmbH对移动式摄影X射线机主动召回(注册证编号:国械注进20182300009)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年8月23日

附件:


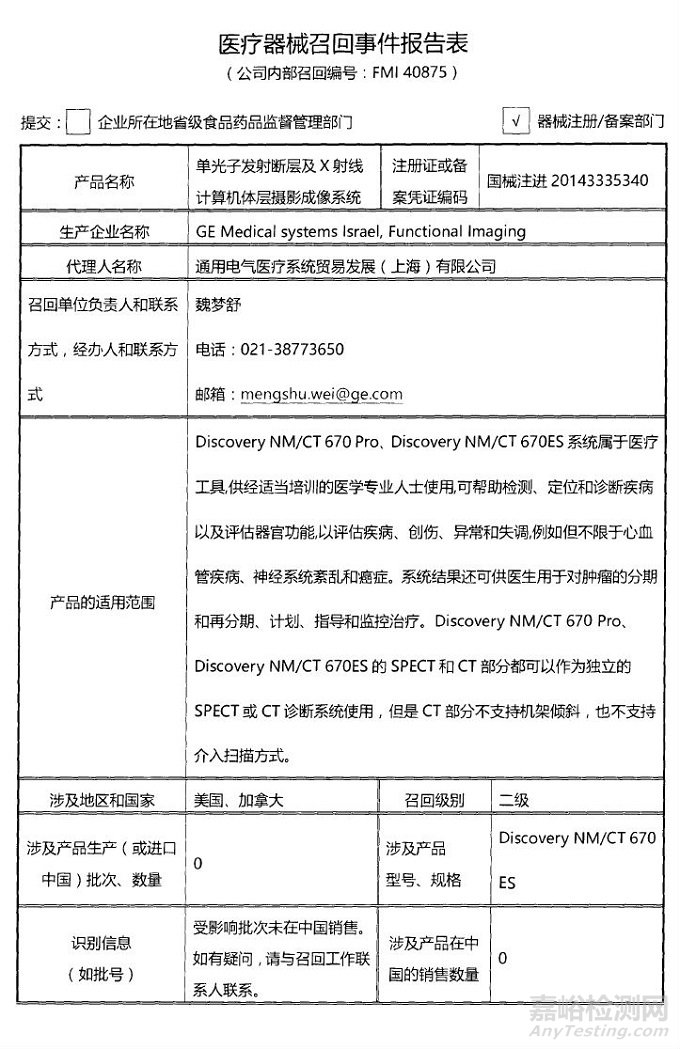
GE Medical systems Israel, Functional Imaging对单光子发射断层及X射线计算机体层摄影成像系统主动召回
通用电气医疗系统贸易发展(上海)有限公司报告,由于少数装有GE供应的A1电路板的核系统无法正确地与UPS系统相连接,生产商GE Medical systems Israel, Functional Imaging对单光子发射断层及X射线计算机体层摄影成像系统(注册证编号:国械注进20143335340)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年8月23日

附件

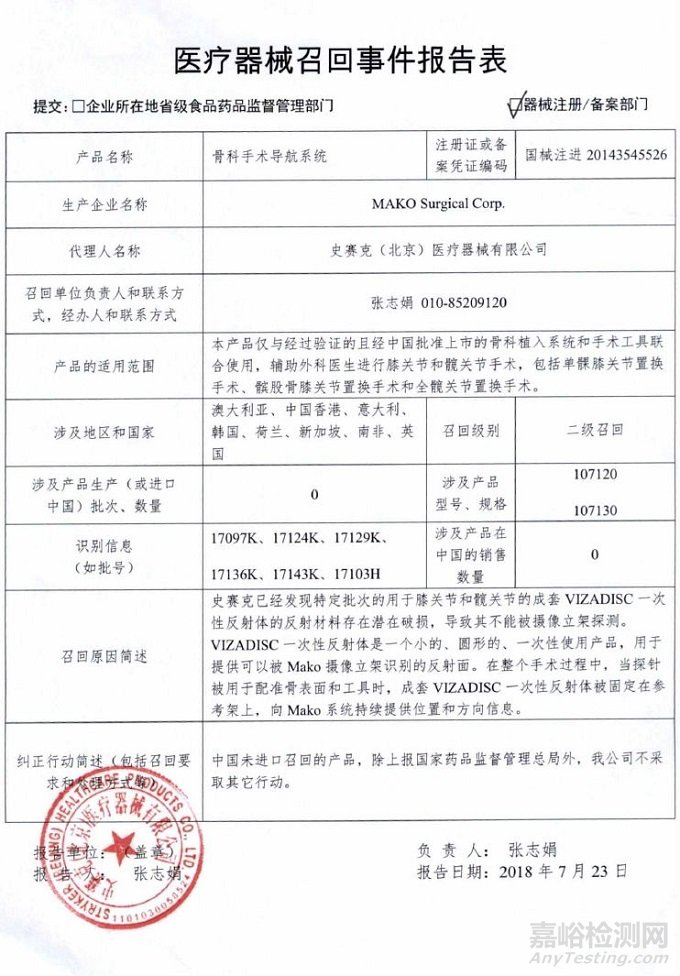
 MAKO Surgical Corp.对骨科手术导航系统主动召回
MAKO Surgical Corp.对骨科手术导航系统主动召回
史塞克(北京)医疗器械有限公司报告,由于成套VIZADISC一次性反射体的反射材料存在潜在破损,导致其不能被摄像立架探测,生产商MAKO Surgical Corp.对骨科手术导航系统(注册证编号:国械注进20143545526)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年8月23日
 附件
附件
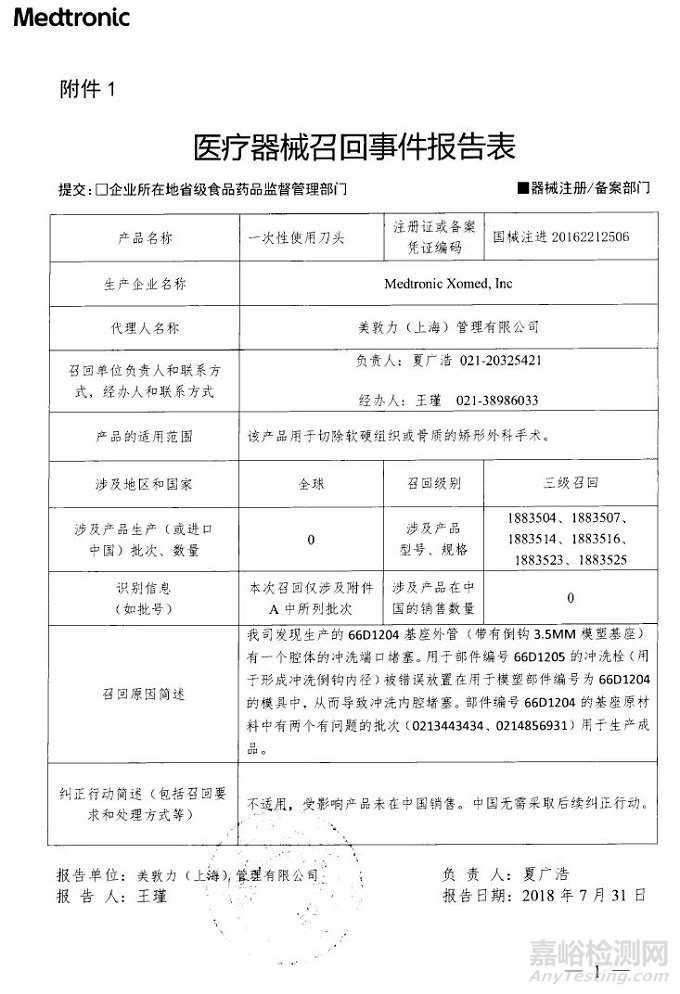
 Medtronic Xomed, Inc对一次性使用刀头主动召回
Medtronic Xomed, Inc对一次性使用刀头主动召回
美敦力(上海)管理有限公司报告,由于发现生产的66D1204基座外管(带有倒钩3.5MM模塑基座)有一个腔体的冲洗端口堵塞,生产商Medtronic Xomed, Inc对一次性使用刀头(注册证编号:国械注进20162212506)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年8月23日
 附件:
附件:
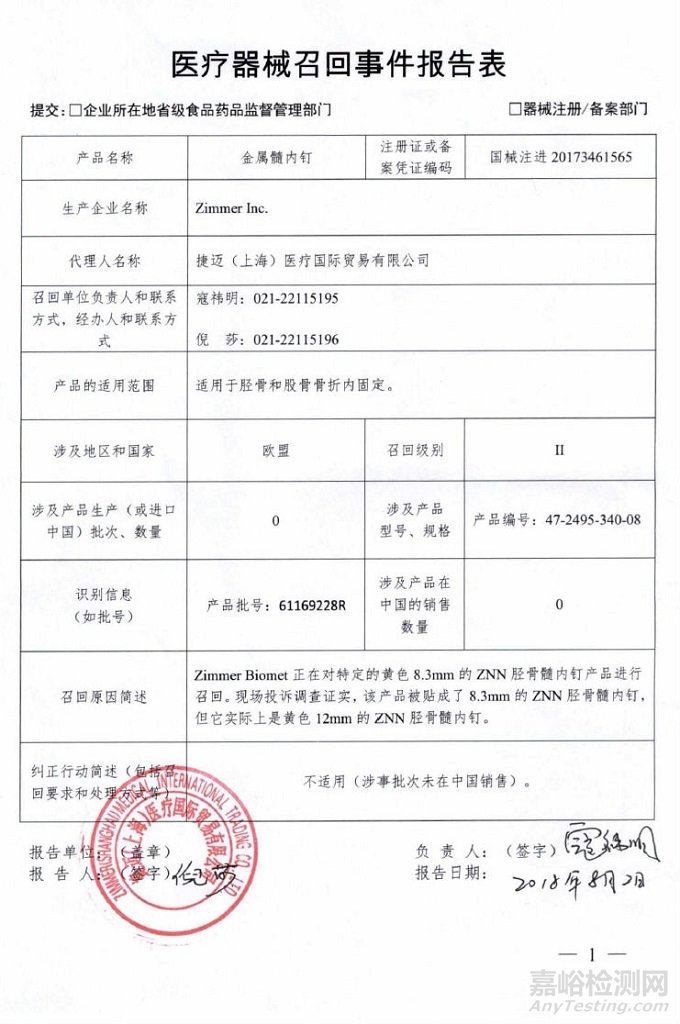
 Zimmer Inc.对金属髓内钉主动召回
Zimmer Inc.对金属髓内钉主动召回
捷迈(上海)医疗国际贸易有限公司报告,由于产品标签错误,生产商Zimmer Inc.对金属髓内钉(注册证编号:国械注进20173461565)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年8月23日
 附件:
附件:
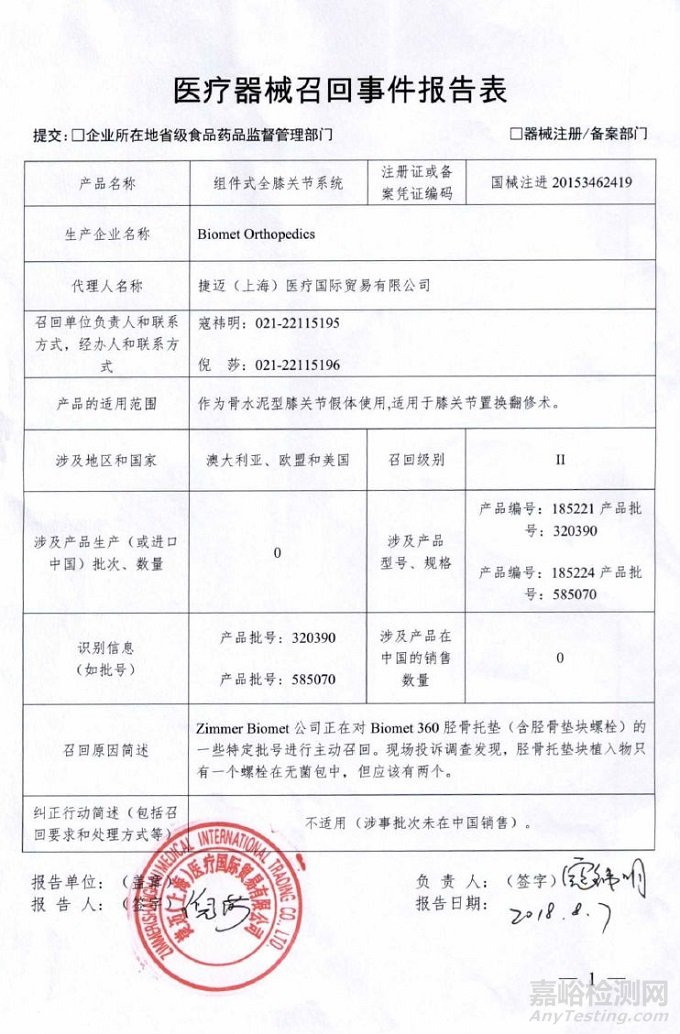
 Biomet Orthopedics对组件式全膝关节系统主动召回
Biomet Orthopedics对组件式全膝关节系统主动召回
捷迈(上海)医疗国际贸易有限公司报告,由于胫骨托垫块植入物在无菌包中少了一个螺栓,Biomet Orthopedic对组件式全膝关节系统(注册证编号:国械注进20153462419)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年8月23日
 附件:
附件:

来源:国家药监局


