您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2018-06-13 12:01
引 言
强制降解试验到底应该怎么做才合适?
具体的操作细节应该如何执行?
符合FDA要求的稳定性指示方法建立的具体步骤是什么?
这是很多从事质量研究的人员都想弄明白的问题,《Development of forced degradation and stability indicating studies of drugs-A review》一文给出了答案。
1. 前言
药物分子的化学稳定性是一个非常值得关注的问题,因为它会影响药物产品的安全性和有效性。了解分子的稳定性有助于选择合适的配方和包装,并提供合适的贮存条件及有效期。强制降解试验是在比加速试验条件更剧烈的条件下研究药物的降解途径与降解产物,从而确定分子的化学稳定性的方法。ICH指导原则指出,强制降解试验旨在识别可能的降解产物,建立降解途径,明确分子的化学稳定性,并验证所选择的稳定性指示方法(1)。但是这些指导原则只是概括性的论述,并没有提供具体操作的细节。
新药申报中要求提交长期试验(12个月),加速试验(6个月)或中间条件(6个月)的稳定性数据,因此对降解杂质的分离、鉴定、定量研究所需的时间会很长。强制降解试验在很短的时间,如几周内就可以产生降解杂质,有助于杂质的研究。强制降解试验可以用来开发用于加速长期试验的稳定性指示方法,本文对强制降解试验的设计及其在开发稳定性指示方法方面的应用,提出了一些重要建议,值得借鉴和思考。
2.强制降解试验的目的是什么?
建立原料药和制剂的降解途径
区分配方中与制剂相关和不相关的降解产物
阐明降解产物的结构
确定处方中原料药的内在稳定性
揭示原料药和制剂的水解、氧化、热解或光解等降解机制(1,2)
建立稳定性指示方法
了解药物分子的化学性质
确定更加稳定的处方
产生一个与ICH正式稳定性试验相似的降解杂质谱
解决稳定性试验中有关的问题(3)
3.何时进行强制降解试验的研究?
在新药和仿制药研发中了解何时进行降解试验是很重要的。FDA建议在phase III阶段进行降解试验。对于API,应进行不同pH溶液、氧气和光照、高温高湿条件下的降解试验。采用一批样品进行,结果在年报中进行提交(4)。然而,在preclinical phase或phase I阶段非常鼓励对API进行降解试验研究,目的是有足够的时间来确定降解产物、结构确证、优化降解条件。一个早期的降解研究对于API生产工艺的改进以及选择恰当的稳定性指示方法也具有一定意义(5,6)。
4.降解多大程度才合适呢?
降解多少才合适这一问题在药学研究人员中是一个经常讨论的问题。在色谱分析方法中一般认为降解5%-20%是合理的,对于分析方法验证来说降解10%为最优(7,8)。有些科学家认为对于含量下限为90%的小分子药物来讲10%的降解程度是最佳的。有其他科学家建议可在API中加入降解杂质在制剂的稳定性考察过程中监控其稳定性(2)。
没必要强求强制降解试验一定要产生降解产物。如果在加速稳定性方案中的降解条件下API或制剂没有降解,那么降解研究可以终止(11)。这说明产品具有良好的稳定性。过度降解可能导致二级降解产物,而这在产品的储存期间可能并不会产生(12)。由于制剂中的辅料和主药浓度与API不同,因此制剂的产生降解杂质的方案可能与API是不同的。推荐在溶液中进行最长为14d的降解试验(氧化降解试验最长24h),为方法开发提供降解样品(13)。
5.如何设计降解条件(策略)?
降解条件的选择应与产品在正常生产条件、贮藏、使用条件相关,因药而异(9)。对于API和制剂,通常的降解方案如下流程图所示:
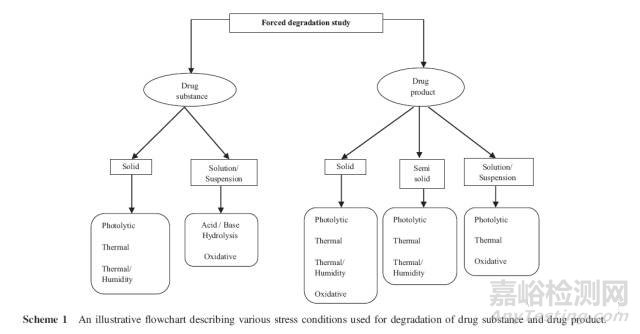
降解条件最少应包括酸碱水解、热、氧化、光照(5,14-16)、还可能有冻融循环等(10)。指导原则中没有pH、温度、氧化剂的特别规定。光降解试验的设计是根据ICHQ1B中的光源应包括可见光和紫外光(UV,320-100nm)(11)。最初目标是找到使API产生大约10%降解的条件。降解试验中最常用的降解条件见表1(17)。
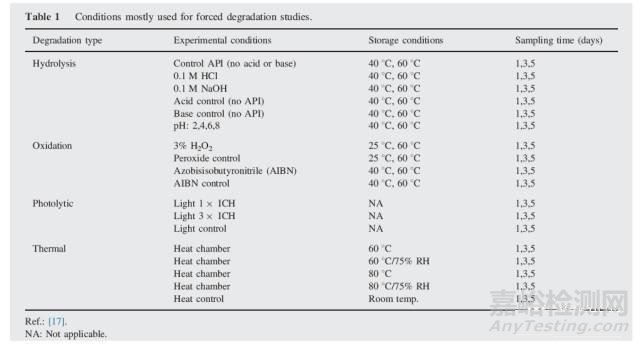
一些科学家发现开始时使用80℃条件或更高条件在短时间(2,5,8,24h等)多个时间点测定降解率是很实用的(18),主要降解杂质和次级降解杂质会通过早期时间的检测进行区分开来,有助于更好的理解降解途径。还有一种方法是使用API按表1中的条件开始降解,然后根据情况增加或降低条件来获得足够的降解。与剧烈条件和短时间方法相比,这种降解策略较好,理由是:
(i)当使用剧烈条件时降解机理可能发生改变;
(ii)当使用高浓度反应试剂,如酸、碱等,在进行HPLC 分析时,样品可能需要中和或稀释。
这些原因说明,降解时应尽可能采用正常条件进行(19)。当处方或方法发生变更时,应重新进行降解试验,因为这些变更可能导致新的降解杂质出现。
6.样品浓度选择多少合适?
降解试验中采用何种浓度?目前指导原则中没有规定。文献推荐采用1mg/ml作为起始研究浓度(20),这通常可以获得很小的降解杂质。有些降解研究建议在最终处方浓度下进行(19),如aminopenicillins 和aminocephalosporins在最终商业处方中浓度很高,会产生一系列的聚合物杂质(21)。
7.降解条件分析
7.1水解降解
水解是在较宽pH范围内进行的一个最常见的化学降解反应,包括化合物与水的反应。酸和碱的水解反应涉及分子中基团的离子化。酸碱降解包括药物与酸或碱接触后产生主要降解杂质。酸或碱的种类和浓度的选择取决于药物的稳定性。一般选择盐酸或硫酸(0.1-1M)为酸水解和氢氧化钠或氢氧化钾(0.1-1M)作为碱水解的条件(20,22)。如果化合物难溶于水,可加入其他助溶剂使其在盐酸或氢氧化钠溶液中溶解。助溶剂的选择应基于药物的结构。降解试验一般从室温开始,如果没有降解,则提高温度为50-70℃。降解不应超过7d。降解样品用适当的酸、碱或缓冲液中和,以避免进一步发生降解。
7.2氧化降解
过氧化氢被广泛用于药物的氧化降解研究中,但其他氧化剂如金属离子、氧气和自由基引发剂(azobisisobutyronitrile,AIBN,偶氮二异丁腈)也可以使用。氧化剂的种类、浓度、氧化条件的选择取决于药物本身。文献报道样品采用0.1-3%过氧化氢溶液在中性pH条件、室温下放置7d或者最大产生20%的降解可能会生产相关降解杂质(22)。药物的氧化降解涉及电子转移机理,形成阴离子和阳离子。胺、硫化物和苯酚易受电子转移氧化产生N -氧化物、羟胺、砜和亚砜(23)。不稳定氢如苄基碳、烯丙基碳、和叔碳或α-位氢原子容易氧化形成氢过氧化物、羟基或酮(24,25)。
7.3光降解
药物的光降解试验应证明对光不会发生变化。光降解试验应将药物置于UV或荧光条件下产生主要降解杂质。推荐条件见ICH指导原则(11)。原料或固体/液体制剂应采用1.2 million lx h和200Wh/m2的光进行研究。通常采用300-800nm波长进行光降解(26, 27)。最大光照强度为6 million lx h(25)。光降解可通过自由基机制诱导产生光氧化。羰基、硝基芳烃、N-氧化物、烯烃、芳基氯化物、弱C–H和O–H键、硫化物和多烯可能产生药物的光敏性(28)。
7.4热降解
热降解(例如,干热和湿热)应该在比ICH Q1A规定的加速条件更剧烈的情况下进行。固态的原料和制剂样品应该在干热和湿热的条件下进行研究;而液体制剂应在干热条件下进行研究。研究应该在较高温度较短时间下进行(22)。温度对热降解的影响可以通过Arrhenius方程进行表示。
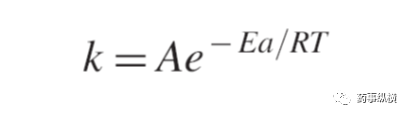
其中,k为速率常数,A为频率因子,Ea为表观活化能,R为摩尔气体常数(1.987 cal/deg mole),T为热力学温度(25,29,30)。热降解研究在40℃-80℃条件下进行。
8.什么是稳定性指示方法?
稳定性指示方法(SIM)是用来对制剂中API的降解进行定量测定的方法。在FDA指导原则中SIM是一个定量分析方法,可以用来检测药物和制剂随时间变化的稳定性情况。SIM在检测API时,不应受到降解产物、杂质和辅料的干扰(14)。降解试验是用来研究SIM方法的专属性的。开发一个SIM可以用于处方前研究、稳定性研究、贮藏条件开发。Bakshi和Singh(19)讨论了开发SIM方法的关键问题。Dolan(31)对稳定性指示含量方法进行了讨论并提出了建议。Smela(32)从法规角度讨论了SIM。反相HPLC法广泛用于杂质的分离和定量,通常与UV检测器联用(29)。以下是采用HPLC开发满足法规要求的SIM方法的步骤:
8.1样品
开发SIM方法时,API的降解条件应比加速试验剧烈,包括水解、氧化、光照、热条件。API进行固体和液体条件下的降解是为了真实贮藏条件下可能产生的降解杂质(33)。
8.2方法开发与优化
在方法开发前,应了解药物的理化性质,如pKa,logP,溶解度,最大吸收,为HPLC方法的开发奠定基础。logP和溶解度有助于选择流动相和溶剂,而pKa有助于确定流动相的pH值(19)。
分离样品时首选反相色谱柱,不同比例的甲醇、水、乙腈可以作为初始条件进行分离研究。选择甲醇还是乙腈,应基于分析物的溶解度。开始时水-有机相比例可以为50:50,可加入适当的调节剂来获得好的分离度。如果想获得好的分离度与峰对称性可以加入缓冲液。如果方法用于进行LC-MS,流动相缓冲液应是MS兼容的,如三氟乙酸或甲酸铵。色谱柱温度的变化可影响方法选择的变化,这是因为分析物对温度变化的反应不同。30-40℃的柱温适合产生好的分离重现性(34)。最好是药物色谱峰在色谱图中晚出,这样可能使所有的降解产物分离,但在药物色谱峰后也应运行足够长的时间来保证药物色谱峰后的降解杂质能够充分洗脱出来(19)。
在方法开发中有时会出现药物色谱峰中藏着一个杂质峰或降解物峰与药物一起洗脱下来的情况。这时需要峰纯度的检测来确定方法的专属性。采用PDA检测器可以在线分析,PDA提供峰光谱是否同质的信息,但是不能用于与药物具有相同UV光谱的降解杂质分析。直接方法包括改变色谱条件中的流动相比例、色谱柱等,来改善分离。调整色谱条件后再进行光谱比较。如果降解物峰和药物峰面积的百分比一样,可以认为药物峰是同质的(35)。与药物共洗脱出的降解产物如果加速试验和长期试验中不产生是可以接受的(1)。方法可以通过调节流速、进样体积、色谱柱类型、流动相比例进行邻近色谱峰的优化。
8.3方法验证
开发的SIM方法应根据USP/ICH指导原则进行线性、准确度、精密度、专属性、定量限、检测限、耐用性和耐受性的验证。应该能够分离、识别、定量鉴定限(通常为0.1%)以上的杂质(36,37)。如果方法验证不符合要求,应进行调整和重新验证(35)。
9.其他用来开发SIM的方法有哪些?
SIM方法的选择因产品而异,包括很多方法,如电泳、HPLC、peptide mapping(39)等方法。选择的方法应足够敏感,可以检出较低水平的杂质(如0.05%),且峰响应值应在检测器的线性范围内。分析方法应检测出所有在正式稳定性试验中产生的杂质(40,41)。LC-MS或LC-NMR法可以用来鉴定降解产物。采用这些方法可以更好的对基因毒性杂质进行研究和严格控制(36,39-43)。需要注意的是,在正式的稳定性研究中超过鉴定限以上的杂质需要进行结构确证(40)。
有很多新的分析技术可以用来进行SIM方法的开发(44)。在API和制剂的检测、药物开发、降解试验、正式稳定性研究中,未知杂质可以通过各种技术进行分离和分析,如RP-HPLC、TLC、GC、CE、CEC、SFC。HPLC-DAD、LC-MS、LC-NMR、GC-MS可以用来对未分离的降解物进行研究。HPLC-DAD、LC-MS可以用来比较相对保留时间、UV光谱、质谱(MS/MS或MSN)(29)。Singh和Rehman讨论了联用技术在降解物和杂质分离方面的应用(45)。

来源:AnyTesting


