您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2018-05-29 09:45
医疗器械产品辐射灭菌常见问题解析
辐射灭菌凭借其低温无菌,无残留,操作安全等优势,越来越广泛应用于医疗器械产品。
医疗器械进行辐射灭菌之前需进行灭菌确认,这是保证医疗器械无菌保证水平的重要途径。GB18280系列标准为医疗保健产品辐射灭菌确认、加工和常规监测相关工作正确进行提出了各种要求。
2015版标准分为三个部分:
GB18280.1-2015 《医疗保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》
GB18280.2-2015 《医疗保健产品灭菌 辐射 第2部分:建立灭菌剂量》
GB/T18280.3-2015 《医疗保健产品灭菌 辐射 第3部分:剂量测量指南》
GB18280.1-2015和GB 18280.2-2015,为强制标准,于2017年7月1日起实施,取代了GB18280-2001标准。本文笔者将针对辐射灭菌标准实际运用过程中,灭菌剂量和最大可接受剂量建立,剂量分布结果分析、灭菌有效性的继续保持等四个常见问题进行解析。
(一) 如何选择建立辐射灭菌剂量的方法
《GB 18280.2-2015 医疗保健产品灭菌辐射第2部分:建立灭菌剂量》标准中建立灭菌剂量的方法有:方法一、方法二和VDmax方法。
方法一是应用生物负载信息建立灭菌剂量,方法二是应用微生物抗性的信息建立灭菌剂量,这两种方法均可以获得一个产品特有的剂量,而VDmax方法是对选定的剂量进行证实。
通俗的理解就是,灭菌的效果取决于微生物的数量和微生物的种类,微生物的数量用生物负载来表示,微生物的种类用抗性来衡量,不同种类的微生物抗性不同,方法一和方法二就是在此基础上进行的。VDmax方法可以理解为数学上的证明题,通过科学的方法证实选定的剂量有效。
三种方法各有其优点和缺点,需要根据产品实际情况进行选用:
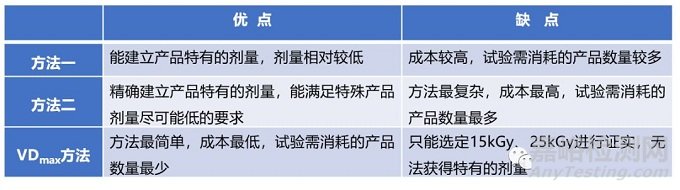
实际操作中,VDmax方法,因其特有的优势,使用最普遍。GB 18280.2-2015标准中,对三种方法的具体实施有详细的讲解及举例说明。方法二基本很少用到,在此对方法一和VDmax方法梳理如下:
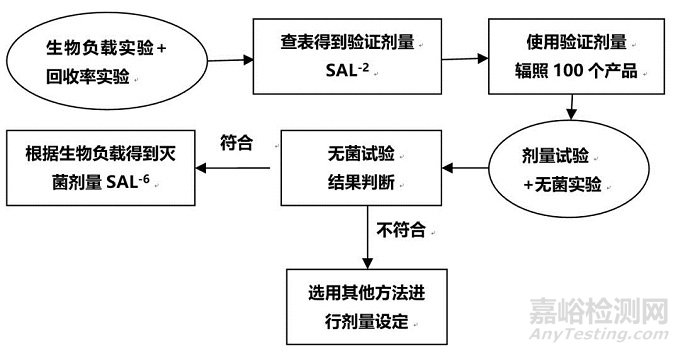
方法一:
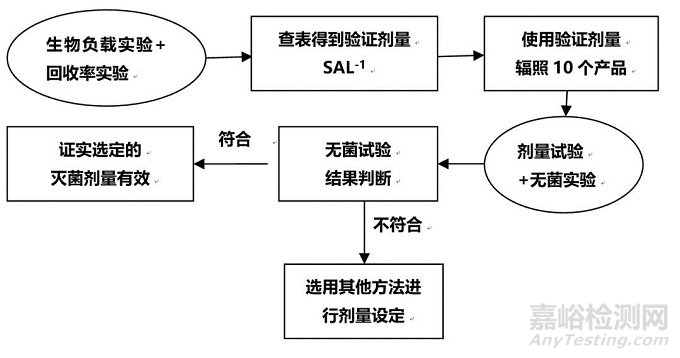
VDmax方法:
SAL(sterilityassurance level):无菌保证水平,指灭菌处理后单位产品上存在活微生物的概率。SAL通常表示为10-n。如,设定SAL为10-6,即经灭菌处理后在一百万件物品中最多只允许有一件物品存在活微生物。
根据两张图就能轻易的发现,其实VDmax方法就是方法一的一个延伸与简化,简化主要体现在,VDmax方法验证剂量采用的无菌保证水平为SAL-1,因此验证剂量辐射时产品数量由100个减少到了10个。两者的不同,在图中也得到了体现,方法一最终是根据生物负载获得SAL-6的灭菌剂量,VDmax方法是证实了选定的剂量有效。
此外,为了弥补VDmax方法的不足,《GBT 31995-2015 医疗保健产品灭菌 辐射 证实选定的灭菌剂量-VDmax方法》对VDmax方法进行一个扩展,选定剂量增加了7个,分别为:15kGy、17.5 kGy、20 kGy、22.5 kGy、25 kGy、27.5 kGy、30 kGy、32.5 kGy、35 kGy 。需要提醒的是对应的ISO/TS13004-2003标准目前尚为建议稿,采用时需要考虑目标市场监管机构的认可情况。
(二) 如何建立辐射灭菌最大可接受剂量
最大可接受剂量:过程规范所规定的剂量,作为最大剂量,能被应用到规定产品而又不会危及产品的安全、质量和性能。(GB 18280.1-2015)
建立产品的最大可接受剂量,是灭菌确认中非常重要的环节,一方面它直接决定应该选用哪种方法建立灭菌剂量,同时也受剂量分布即装箱模式制约。当然,最主要的是它直接影响产品安全、质量和性能。
《YYT 0884-2013适用于辐射灭菌的医疗保健产品的材料评价》对最大可接受剂量的建立提供了理论依据,接下来我通过实例从操作层面来讲解如何开展最大可接受剂量试验。
如果我们希望选用25kGy的灭菌剂量,剂量分布试验的不均匀度为1.5,计算得出25*1.5 =37.5kGy,再考虑到辐射加工过程的系统偏差及不确定度,最大可接受剂量如果是40kGy,日常控制基本很难满足。那么,具体如何做呢?
第一种情况:在装箱模式不更改的情况下,即已知不均匀度为1.5的情况下,灭菌剂量希望选用25kGy,如何进行最大可接受剂量试验呢?
可以通过选用50kGy辐射,来评估产品性能是否仍然满足要求,这里需要重点注意的是需要考虑寿命期内,产品性能是否满足要求。
如果工作做得更细,风险更低一些的话,可以同时做45kGy、50kGy、55kGy三个剂量辐射产品,然后根据验证结果,确定产品真正的最大可接受剂量。
第二种情况:产品性能对剂量比较敏感,最大可接受剂量只能是40kGy,灭菌剂量希望选用25kGy,该如何做呢?
此时需要对装箱模式进行调整,尽可能的减小不均匀度,如果不均匀度减小到1.2时,最大可接受剂量40kGy就变成可以实现了。
第三种情况:不均匀度1.5,最大可接受剂量40kGy都已经确定的情况下,该如何做呢?
此时灭菌剂量不能选用25kGy,可以改用15kGy或者方法一建立灭菌剂量。
总之,最大可接受剂量不是孤立存在的,与剂量设定和剂量分布都有着密切的关系,需要结合起来一同考虑。
(三) 辐射灭菌剂量分布试验结果分析
剂量分布试验即性能鉴定,主要是为了输出产品在辐射容器中的剂量分布图,通过剂量分布图中的最大、最小剂量,计算出不均匀度。此时,就可以判断,剂量分布情况是否能够同时满足灭菌剂量和最大可接受剂量。
剂量分布主要取决于装箱模式,对每种产品类型都应建立其产品装箱模式。装载模式对剂量分布的影响,不仅需要考虑产品在辐射容器中的数量、摆放位置、方向和密度,还需要考虑产品在包装箱中的数量、摆放位置和方向。
具体试验过程,需要考察3个或3个以上辐射容器的剂量分布,以确定各辐射容器之间剂量分布的差异;同时还应对产品所经过的不同传输路径做剂量分布实验,以确定不同的传输路径对产品吸收剂量的影响。
通过剂量分布试验最终确定产品的辐照参数,主要包括:产品的装箱模式、最大最小剂量的量和位置、日常剂量监测的位置及与最大最小剂量的关系。
(四)辐射灭菌有效性的持续保持
灭菌确认完成后,仍需要重点关注灭菌有效性的持续保持。因为灭菌是特殊过程,其效果是不能用后续检验证明的,只有在生物负载数量、种类稳定,产品密度不变,且辐射源种类相同的情况下,才能保证灭菌剂量有效。
灭菌剂量的持续有效性应通过如下方式证明:
a) 确定生物负载以监视与生物负载规定限度相关的产品中存在的微生物数量;
b) 执行灭菌剂量审核以监测产品上的生物负载辐射抗力。
注:灭菌剂量的审核方法描述见GB18280.2-2015,包括生物负载的确定
最后强调一点,任何可能引起剂量或剂量分布的变更,都应得到评估,并记录评估的结果和评估的依据。

来源:医疗器械从业者


