您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-04-02 10:11
1.前言
俄罗斯医疗器械市场是一个很广阔并有机会的市场,与此对应的是俄联邦对于医疗器械的流通监管和上市后监督也极其严格,我们国内很多企业在产品研发初期为了快速推向市场,有些都会选择先进行初代产品的研发,上市获批后再进行持续的优化,这样就会带来一定的设计变更。如何按照法规要求确保获批产品以及后续的设计变更持续符合监管的要求是各个职能需要重点关注的问题。本期就给大家带来俄罗斯医疗器械注册之变更注册相关的知识分享。
2.俄罗斯医疗器械变更注册法规要求
俄罗斯联邦政府与2024年11月30日发布了关于批准“医疗器械国家注册规则” 的第1684号令。规则中第111条、第119条是针对医疗器械变更注册的管理规定。第111条针对的是对注册档案中所含文件所做的变更但不影响医疗器械的质量、有效性和安全性,第119条针对的是对注册档案中所含文件所做的变更触发对医疗器械质量、有效性和安全性进行审核。
申请人应当在相关数据发生变更之日起90个工作日内,向注册审核机构在线递交相关变更资料。(注:资料格式需以PDF文档格式提供,且分辨率高于300dpi及可编辑)
规则中还规定了以下变更不属于注册变更,应当按照新产品进行医疗器械注册:
变更会更改医疗器械的功能目的和/或操作原理;
包含不符合本规则第26条规定的已注册医疗器械型号(品牌)的变更信息;
涉及制造商和生产地址信息同时变更的。
3.俄罗斯医疗器械注册变更具体实施要求
RZN 1684号令第111条所指变更与NMPA所规定的变更对应的意思就是登记事项变更,包括:
a).原注册资料中所含文件有效期的变更;
b).1类或2a非无菌类制造商引入的变更,但制造商已根据医疗器械质量管理体系进行了相应的评估,包括医疗器械的设计和开发过程;
c).医疗器械制造商信息、当地授权代表信息的变更:
1)法人实体重组;
2)法人实体名称及其所在地址变更;
3)个体企业家(如是)信息的变更;
4)更改生产地址(注意此更改由于地理对象的更名,或街道地址更名或门牌号编号的变更,实际生产地址还是在原来实体地理空间上);
d).以商标和其他个性化方式更改医疗产品名称的;
e). 从已有注册证中删除有关医疗器械型号(品牌)信息的;
f). 更改标识设计但不更改用于医疗器械符号标识的;
g). 医疗器械注册完成或变更注册完成后,由于新版分类编码发布而需更改分类编码的。
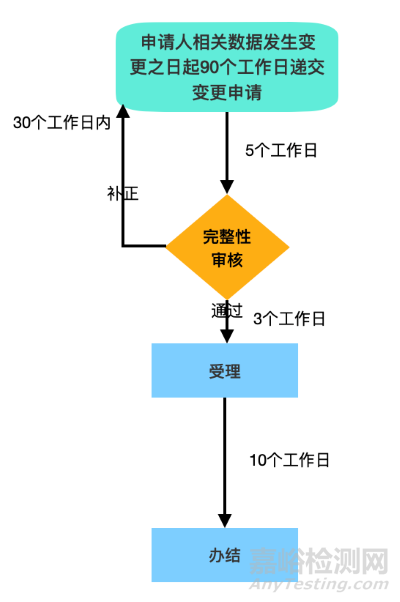
登记事项变更流程图参考
针对此类变更,制造商需准备并提供:
1.1684号令第64条规定的相关信息,以及其它所需修改的信息,以及(如适用)有关临床器械临床试验结果的信息;
2.制造商授权代表的授权信,确认授权代表具有相关权力代表制造商的利益,承担医疗器械流通监管责任及注册事宜;
3.1684号令第65条规定的信息
4.制造商生产质量体系检查报告(针对第111条b点规定)
RZN 1684号令第119条所指变更是指除第111条规定之外的变更,与NMPA所规定的变更对应的意思就是许可事项变更。
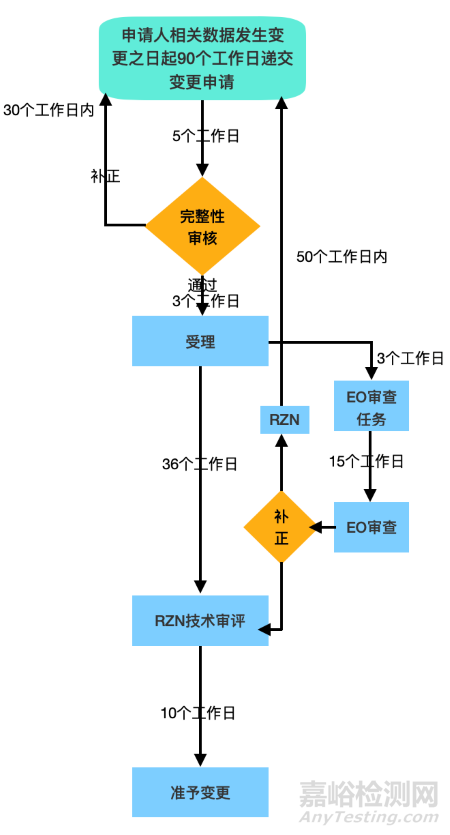
行政许可事项变更流程图参考
如需进行此类注册变更,制造商需准备并提交以下资料:
1.1684号令第64条规定的相关信息,以及其它所需修改的信息,以及(如适用)有关临床器械临床试验结果的信息;
2.制造商授权代表的授权信,确认授权代表具有相关权力代表制造商的利益,承担医疗器械流通监管责任及注册事宜;
3.质量管理体系证明(如 ISO 13485-2016)
4.1684号令第65条规定的信息
此外,1684号令还规定了含有人工智能软件的医疗器械变更注册的定义和具体要求。

来源:Helonmed芊隆医械资讯


