您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-07 15:54
编者按
为认真落实省委省政府、省市场监督管理局、省药品监督管理局关于优化审评服务与营商环境的有关要求,进一步加强对我省第二类医疗器械产品注册申报的指导服务,帮助注册申请人提升注册申报的质量和效率,江苏省药监局审评中心梳理统计2023年第二类有源医疗器械变更注册申报资料的常见问题,供广大注册申请人参考。
一、变更注册常见问题分布情况
(一)总体概况
2023年江苏省药品监督管理局审评中心共受理第二类有源医疗器械变更注册438件,已处理372件,发出补正通知书372件,发补率100%,其中的328件需要补检,补检率88.2%。以下是对发补常见问题的分析:
变更注册发补涉及163家企业,发补意见主要集中在申请表信息、符合性声明、产品技术要求、产品检验报告、研究资料、临床评价资料、变更后说明书七部分,各部分的发补意见分布情况如下图所示:
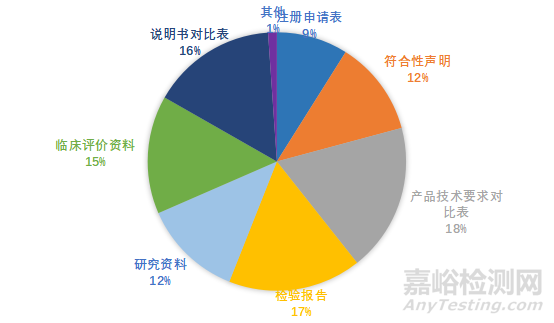
图一 变更注册审评发补意见分布
(二)变更注册审评发补的主要补检项分布情况
变更注册补检率88.2%,主要是以下三种类型的许可事项变更需要补检:
(1)新增型号:新增的型号不能被老型号覆盖,应对新增的型号进行型式检验。
(2)结构组成变化:产品结构组成发生的变化若影响电气结构,应进行电气检测。
(3)产品技术要求变化:新版9706系列电气标准、产品性能指标变化、检测方法变化,均应进行检测。
以上三种类型的许可事项变更补检项分布情况如下图所示:
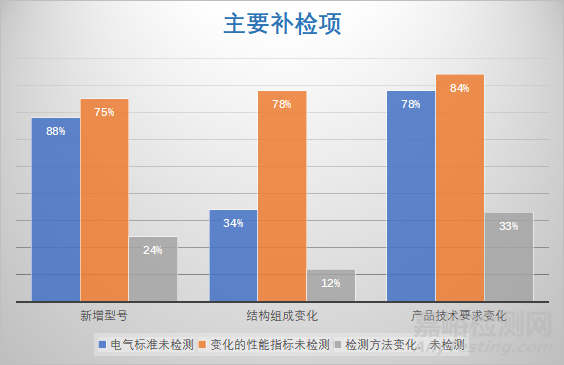
图二 变更注册审评发补的补检项分布情况
二、常见问题分析
1、注册申请表
产品新增型号,根据《医疗器械注册单元划分指导原则》及相应产品的指导原则,若新增的型号与老型号技术原理、结构组成、性能指标、适用范围不同时,原则上划分为不同注册单元。例如雾化原理不同,超声雾化器和微网雾化器不能作为一个注册单元。
申请表中 “许可事项变更注册”的勾选存在漏选错选问题。如:产品技术要求中有产品型号信息,申报产品型号发生变化,“许可事项变更注册”未勾选“产品技术要求变化”项。
2、符合性声明
企业应关注国行标更新动态,有源医疗器械重点关注标准如下:
(1)应关注新版9706系列电气标准,如:
GB 9706.1-2020医用电气设备 第1部分:基本安全和基本性能的通用要求;
GB 9706.218-2021医用电气设备 第2-18部分:内窥镜设备的基本安全和基本性能专用要求;
GB9706.111-2021医用电气设备 第1-11部分:基本安全和基本性能的通用要求 并列标准:在家庭护理环境中使用的医用电气设备和医用电气系统的要求;
YY 9706.102-2021医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容 要求和试验。
(2)应关注《国家药监局关于92项医疗器械强制性行业标准和在研项目转化为推荐性行业标准和在研项目的公告(2022年第76号)》,部分强制性标准转化为推荐性标准,如:
医用脚踏开关通用技术条件YY 1057-2016 转化为YY/T 1057-2016;
医用超声雾化器YY 0109-2013转化为YY/T 0109-2013。

来源:江苏省药监局审评中心


