您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-22 10:51
本文适用于多孔腹腔内窥镜手术系统(简称手术系统)中的三维内窥镜(以下简称内窥镜),既适用于具有机械臂接口,可安装在机械臂上由系统进行操控的专用内窥镜,也适用于不由机械臂操控可独立使用的通用内窥镜。
单独注册时,产品分类编码为06-14-01或06-14-03。与手术系统一起注册时,分类编码为01-07-03。
一、三维内窥镜的产品工作原理与结构组成
1、工作原理
三维成像的工作原理至少包括图像采集环节、图像处理环节和三维成像显示环节。
2.2结构组成
内窥镜双路布局图示举例如下:
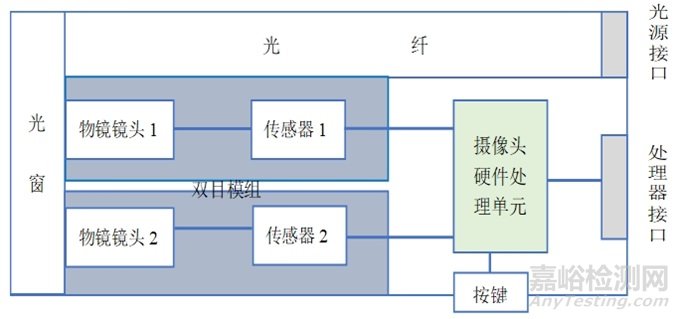
图1 电子内窥镜双路布局图示
图1仅为电子内窥镜双路布局的举例,开发人应根据申报产品的实际设计明确对应图示。
二、三维内窥镜的主要风险
依据GB/T 42062标准,表1列举了内窥镜有关的可能危险示例的不完全清单
表1三维内窥镜相关风险示例
|
危险类型 |
示例 |
|
|
能量 危险 |
电磁能 |
可触及部分(含应用部分)与带电部分隔离/保护不够,可能引起过量漏电流对操作者或患者造成电击危害。 |
|
配合使用的高频手术设备的辐射发射和/或传导发射影响内窥镜手术控制系统性能的风险。 |
||
|
产品电磁屏蔽、滤波和接地设计以及抗干扰设计不充分,可能导致设备对外界电磁辐射超标或设备受外部电磁干扰出现工作异常。 |
||
|
与高频手术设备配合使用时需满足一些互连条件,以确保足够的隔离和防护。 |
||
|
防电击程度设计与产品的预期用途不匹配造成的漏电流过大的风险。例如,在进行需要CF设备的手术时,所有设备都必须至少为CF型。 |
||
|
热能 |
在长时间通光的情况下会在内窥镜头端部产生很高的热量,可触及部分/应用部分温升过高,可能导致操作者或患者烫伤或点燃其他接触的物体。 |
|
|
与激光设备配套使用时,内窥镜可能反射激光能量,损伤使用者眼睛。 |
||
|
机械能 |
如果内窥镜进入人体部分表面有缺口、断裂或划痕,那么在进入人体的时候这些粗糙的边缘可能引起组织的损伤。 |
|
|
操作不当,内镜可能对人体组织造成机械损伤。 |
||
|
结构强度低导致零部件脱离遗留人体,造成组织损伤。 |
||
|
生物学和化学危险 |
感染 |
可重复使用内窥镜清洁灭菌不充分,造成细菌病毒残留及交叉感染的风险。 |
|
化学 |
清洁剂或消毒剂的残留物可能引发的危害。 |
|
|
溶解析出物危害:内窥镜与患者接触部分使用的聚合物材料溶解析出物有害物质超标,可能使患者产生不适或毒性反应危害。 |
||
|
生物相容性 |
与患者接触材料不符合生物相容性要求,患者使用后可能出现细胞毒性、刺激和致敏反应危害。 |
|
|
操作危险
|
功能 |
图像传输延时时间过长,影响手术安全。 |
|
三维成像相关性能指标过低,影响手术直觉操作。 |
||
|
图像质量过低,影响手术操作。 |
||
|
类型识别错误(如不同视向角),影响手术系统主从操作性能。 |
||
|
存在三维眩晕症的医师在手术中可能会感受到视觉疲劳或眩晕感。 |
||
|
光学性能不良不符合标准要求,导致光学性能不能达到使用要求,可能造成延误诊疗或误诊等危害。 |
||
|
畸变太大,影响临床使用,可能导致诊查和/或手术中方位混淆、感觉丢失、判断失误等风险。 |
||
|
颜色分辨能力和色彩还原能力不良,可能导致腔内颜色接近、变化细微的组织不能区分,病灶不能识别或判断错误,造成误诊或手术错误的风险。 |
||
|
照明光分布和边缘均匀性不良,可能导致成像不良,临床灰阶识别困难不易诊断或手术失误。 |
||
|
使用错误 |
安装不到位,影响手术。 |
|
|
信息危险 |
标记 |
贴在设备上的警告信息不清晰。 |
|
不完整的说明书。 |
||
|
产品性能特征的不适当描述。 |
||
|
不适当的预期使用规范。 |
||
|
限制的未充分公示。 |
||
|
剩余使用寿命/次数未充分显示。 |
||
|
操作说明书 |
使用前的检查规范不适当。 |
|
|
未提示光辐射安全相关的风险。 |
||
|
使用过程中出现异常时的处理措施描述不充分。 |
||
|
过于复杂的操作说明书。 |
||
|
没有指出兼容的主机型号和其他配套设备。 |
||
|
警告 |
一次性使用附件可能再次使用的危害的警告(如有)。 |
|
|
服务和维护规范。 |
||
三、三维内窥镜的相关标准
三维内窥镜相关标准见表2
表2 三维内窥镜参考标准
|
标准编号 |
标准名称 |
|
GB 9706.1-2020 |
医用电气设备第1部分:基本安全和基本性能的通用要求 |
|
GB 9706.218-2021 |
医用电气设备第2-18部分:内窥镜设备的基本安全和基本性能专用要求 |
|
YY 9706.277-2023 |
医用电气设备第2-77部分:采用机器人技术的辅助手术设备基本安全和基本性能的专用要求(专用内窥镜适用) |
|
YY 9706.102-2021 |
医用电气设备第1-2部分:基本安全和基本性能的通用要求并列标准:电磁兼容要求和试验(含有电子元器件内窥镜适用) |
|
YY/T 1712-2021 |
采用机器人技术的辅助手术设备和辅助手术系统(专用内窥镜适用) |
|
YY 0068.1-2008 |
医用内窥镜硬性内窥镜第1部分:光学性能及测试方法(光学内窥镜适用) |
|
YY/T 0068.2-2008 |
医用内窥镜硬性内窥镜第2部分:机械性能及测试方法 |
|
YY/T 0068.3-2008 |
医用内窥镜硬性内窥镜第3部分标签和随附资料 |
|
YY 0068.4-2009 |
医用内窥镜硬性内窥镜第4部分基本要求 |
|
YY/T 1587-2018 |
医用内窥镜电子内窥镜(电子内窥镜适用) |
|
YY/T 1081-2011 |
医用内窥镜内窥镜功能供给装置冷光源(内置光源适用) |
|
GB/T 16886.1-2022 |
医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
四、三维内窥镜性能研究试验要求
1、化学和物理性能研究
应当明确产品技术要求中化学/材料表征、物理和/或机械性能指标的确定依据、设计输入来源以及临床意义,所采用的标准或方法、采用的原因及理论基础。
专用内窥镜单独注册时,应开展与手术系统联合使用的研究。
如手术系统可适配多个型号的内窥镜(包括通用和专用内窥镜),还应考虑在连接不同的内窥镜时,对手术系统整体性能要求的影响,例如不同视向角的内窥镜可能影响YY/T 1712测试的主从操作准确度和主从操作重复性。
2、电气系统安全性研究
应当开展电气安全性、机械和环境保护以及电磁兼容性的研究。
3、辐射安全研究
内窥镜中如内置光源,应开展光辐射安全研究,可参考《医疗器械光辐射安全注册审查指导原则》。
4、生物学特性研究
内窥镜与人体接触的材质包括镜头、镜体以及胶水(如有)等。应明确与人体接触材料的部件名称、材料名称等信息,明确与人体接触材料对应的位置。同时应考虑生产工艺及清洁灭菌对生物相容性的影响,考虑设计生产过程中可能引入的污染物、残留物、降解产物、加工残留物影响等。
根据GB/T 16886.1的分类要求,内窥镜预期与人体组织短期接触,属于外部接入器械。如需进行生物学试验,通常应考虑细胞毒性、致敏、皮内反应、材料介导的致热性(有可浸提物/可沥滤物适用)、急性全身毒性(有可浸提物/可沥滤物适用)。应对生物学试验情况进行概述。生物学试验可选取典型型号进行,说明典型型号选择依据。生物学试验应最终产品上、或取自最终产品上有代表性的样品上、或与最终产品同样方式加工(包括灭菌)的材料上进行。试验样品应根据制定的清洁、灭菌方法进行处理。
如使用其他产品的生物学试验,应分析试验产品对申报产品的代表性,就试验产品与申报产品的差异性(材料来源或技术规范、产品配方/工艺/初包装或灭菌、运输贮存条件、预期用途、不良生物反应等)对生物相容性的影响进行评价,如评价不足以证明申报产品的生物相容性,应重新开展生物学评价。
与已上市产品相比,如内窥镜中采用新的材料,应明确其理化性能和生物学特性。如豁免生物学试验,可参考《关于印发医疗器械生物学评价和审查指南的通知》中的附2出具开展研究。
5、清洁灭菌研究
由于内窥镜在使用过程中与人体无菌组织接触,每次使用前都应达到无菌要求,应开展清洁、灭菌研究。有多种清洁、灭菌工艺的,每种工艺均应开展研究。可参考美国FDA指南Reprocessing Medical Device in Health Care Settings: Validation Methods and Labeling。研究中清洁灭菌工艺应与说明书中相应内容一致,并在最不利条件下进行研究。
清洁灭菌研究最不利条件考虑因素包括:污染物/菌种种类以及接种位置、多次模拟使用导致的污染物累积(应提供模拟使用次数的确定依据)、最短的作用时间、最低的水温、最低的清洁剂/灭菌剂浓度等。应明确清洁用污染物以及灭菌用菌种的确定依据。
5.1使用者灭菌
内窥镜通常由使用者进行灭菌,应明确推荐的灭菌工艺(方法和参数)、所推荐灭菌工艺的确定依据;应开展灭菌耐受性研究,证明产品按照正常灭菌耐受次数进行清洁、灭菌和使用后,产品性能及安全符合预期要求,可通过对多次再处理并模拟使用后的产品进行性能和安全测试验证,验证的次数应不低于声称的灭菌耐受次数。
进行灭菌确认时应考虑经确认的灭菌程序适用于使用者,包括灭菌工艺、灭菌设备、灭菌包装等。灭菌确认应能证明所推荐的灭菌工艺对于申报产品的灭菌效果,所有器械应接受最恶劣的微生物挑战和灭菌挑战,并在灭菌后进行无菌测试。若经过评价认为申报产品适用于其他已确认产品的灭菌程序,可开展相关的评价和其他产品的灭菌确认研究,评价应对与灭菌有效性相关的特征逐一进行评价,包括生物负载、包装、结构(开口、内表面等)、材料、制作过程等。
对于有可能进入手术无菌区域的连接线缆/光缆,基于使用风险应进行灭菌并开展灭菌研究,或者在使用前用无菌罩对连接线缆/光缆进行隔离。
5.2使用者清洁
应明确内窥镜的清洁工艺、工艺的确定依据并开展相关研究。对于手动清洁,应明确每个步骤的持续时间、温度、水质和其他必要条件(如重复次数和具体的操作方法等)。自动清洁,应指明所有处理条件,明确具体的自动设备设置,如时间、温度和最大负载等。应针对医用清洁剂开展验证研究,医用清洁剂与器械相容性良好且经过确认能够达到预期的清洁效果。应明确冲洗水的类型和质量、冲洗持续时间(或冲洗次数、体积和重复次数)以及温度等参数。研究应明确清洁过程的验收标准,至少应采用一种与临床相关污染物有关的定量试验方法(如蛋白质)。
5.3残留毒性
若产品经灭菌后可能产生残留物质,应当对灭菌后的产品进行残留毒性的研究,明确残留物信息及采取的处理方法。应明确残留物限值的确定依据。对于经环氧乙烷灭菌的产品,需考虑的残留毒性应包括环氧乙烷和2-氯乙醇。应分析影响灭菌残留的各种因素,如解析间温度、换气次数、产品本身的材料、装载方式等,考虑最易产生灭菌残留的情形。
5.4包装
应当证明包装能减少产品受到微生物污染的风险,并且开展适用于生产企业规定灭菌方法的研究。可与灭菌研究合并进行,应证明运输贮存过程中不会增加微生物负载水平,灭菌研究应在最不利的微生物负载下进行。确保清洁灭菌后如何保持无菌状态。
6、动物试验研究
专用内窥镜动物试验要求可参考《腹腔内窥镜手术系统注册审查指导原则第2部分:动物试验决策原则和试验要求》。
通用内窥镜是否需要开展动物试验取决于其与已上市同类产品的差异,当不能通过其他非临床资料证明差异不影响产品的安全有效性时,通常需要开展动物试验。试验通常选择猪模型开展,并设置对照组,对照组器械应为已上市同类产品;不设对照组时,应明确评价指标的确定依据。试验术式应具有代表性。有效性评价指标通常应包括手术效果、手术时间、图像质量(图像清晰度、色彩还原性、亮度均匀性、结构的可辨认性等)、三维视觉(立体感、完整度、实时性、定位准确性以及移动状态下图像的连续性等)、荧光功能(如有)以及术者感受等。安全性评价指标包括手术过程中的不良事件以及内窥镜异常。动物试验样本量应根据试验目的确定。
采用科学原则进行设计确认,如已有的研究资料能够证明申报产品的安全有效性,无需额外开展动物试验研究。
7、稳定性研究
7.1使用稳定性/可靠性
内窥镜通常为非无菌提供,可重复使用。使用稳定性/可靠性研究包括使用期限研究和环境试验研究。
7.1.1使用期限研究
内窥镜的使用期限主要取决于重复使用及再处理引起的性能下降,使用稳定性研究可与灭菌耐受性研究合并进行,通过对产品多次模拟使用、清洁、灭菌后,对产品性能和安全进行验证,证明产品的性能安全满足使用要求。模拟使用时间/次数应与声称的使用期限一致,模拟使用应考虑临床实际工作最不利的状态(考虑内置LED光源的电子内窥镜选择的工作时间,机械臂的运动控制对接口施加的应力等)。
7.1.2环境试验研究
环境试验研究应对声称的正常工作条件进行研究,试验条件可参考GB/T 14710并结合声称进行设定,试验后应对可能受环境影响的性能功能(图像性能、光源性能(如适用)等)进行测试。研究中工作条件范围应不低于说明书中规定的条件。
7.2运输稳定性
应当开展运输稳定性和包装研究,证明在生产企业规定的运输条件下,运输过程中的环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
运输稳定性通常通过模拟运输试验进行,通过模拟在贮存和运输的过程中,遇到极端情况时,例如环境(温度、湿度、气压等)变化、跌落、碰撞、振动、加速度等,产品不会发生性能、功能改变,包装系统具有保护产品的能力。经过模拟试验后,观察包装外观是否有不可接受的异常现象,测试产品性能功能是否符合要求,证明运输过程中的环境条件不会对内窥镜的特性和性能,包括完整性和清洁度,造成不利影响。
运输稳定性可参考GB/ T 14710或GB/T 4857系列标准的要求进行,也可以参考相应的国际标准,运输贮存环境条件范围应不低于产品说明书中规定的条件。

来源:嘉峪检测网


