今日头条
微芯NASH新药Ⅱ期临床积极。微芯生物PPAR激动剂西格列他钠治疗非酒精性脂肪性肝炎(NASH)的Ⅱ期临床(CGZ203研究)达到了主要终点。与安慰剂相比,西格列他钠(48mg、64mg)治疗18周后患者经磁共振质子密度脂肪分数(MRI-PDFF)评估的肝脏脂肪含量(LFC)较基线的降幅更多,具统计学意义;肝脂肪含量下降超过30%的患者比例等次要终点指标也显著改善。此外,药物总体耐受性良好。
国内药讯
1.和黄胰腺癌TKI启动II/III期研究。和黄医药新型口服酪氨酸激酶抑制剂(TKI)索凡替尼登记启动一项II/III期临床,评估索凡替尼联合卡瑞利珠单抗、白蛋白结合型紫杉醇、吉西他滨对比白蛋白结合型紫杉醇联合吉西他滨一线治疗转移性胰腺癌的疗效和安全性。该项研究由天津市肿瘤医院郝继辉博士牵头开展。索凡替尼具有抗血管生成和免疫调节双重活性,主要抑制VEGFR、FGFR和CSF-1R等蛋白。
2.辉瑞血液瘤双抗拟纳入优先审评。辉瑞制药CD3/BCMA双抗Elranatamab(PF-06863135,Elrexfio)获CDE拟纳入优先审评,用于治疗既往接受过至少三种治疗(蛋白酶体抑制剂、免疫调节剂和CD38单抗)的复发或难治性多发性骨髓瘤(R/R MM)患者。在II期研究MagnetisMM-3中,elranatamab在这类难治性患者中经盲法独立中央审查(BICR)评估的客观缓解率(ORR)达到61.0%,有56.1%患者实现非常好的部分缓解(VGPR)或更佳缓解。
3.特瑞思ADC拟纳入突破性疗法。特瑞思药业自主研发的CD20靶向ADC产品TRS005获CDE拟纳入突破性疗法,用于至少经过2次标准治疗的复发或难治性CD20阳性弥漫大B细胞淋巴瘤(DLBCL)。公布于ESMO 2022大会上的I期临床数据显示,TRS005单药治疗复发性或难治性B细胞非霍奇金淋巴瘤(NHL)患者的客观缓解率(ORR)达到37.1%,疾病控制率(DCR)为60%,而且药物耐受性良好。
4.石药“合成致死”新药获批IND。石药集团1类化药SYH2039片获国家药监局临床试验默示许可,拟开发用于治疗晚期恶性肿瘤。SYH2039片是一款高选择性MAT2A抑制剂,已在临床前研究显示出可有效抑制非小细胞肺癌、胶质瘤、胃食管癌、胰腺癌和膀胱癌等多种MTAP缺失型肿瘤细胞的生长,并具有良好的安全性。MAT2A和PRMT5都是MTAP缺失肿瘤的合成致死靶标。
5.信达2款ADC获批临床。信达生物两款1类生物制品IBI130和IBI129分别获得国家药监局临床默示许可。IBI130是一款靶向TROP2的抗体偶联药物(ADC),拟开发用于不可切除的局部晚期或转移性实体瘤。IBI129是一款靶向B7-H3的ADC,开发用于晚期恶性实体瘤的治疗。去年8月,信达生物已在Clinicaltrials.gov网站上登记注册一项Ⅰ/Ⅱ期临床,这项研究预计于2024年底初步完成。
6.百奥泰2款生物类似药授权海外。百奥泰生物宣布已与SteinCares签署授权许可与商业化协议,将其在研生物类似药BAT2506(戈利木单抗)注射液和BAT2606(美泊利珠单抗)注射液在巴西以及其余拉丁美洲地区市场独占的产品商业化权益有偿许可给Stein。根据协议,百奥泰将获得120万美元首付款、累计不超过480万美元里程碑付款,以及产品净销售额的两位数百分比分成。
国际药讯
1.罕见遗传病基因疗法获批上市。Orchard公司基因疗法Lenmeldy(atidarsagene autotemcel,arsa-cel)获FDA批准上市,用于治疗异染性脑白质营养不良(MLD)儿童患者。MLD是由ARSA基因突变引起的一种罕见的溶酶体病,可导致神经损伤和发育退化。在临床试验中,与疾病自然史相比,Libmeldy治疗可使大多数患者的运动功能和认知发育得以保留,随访时间长达12年(中位数6.76年)。
2.BMS骨髓瘤CAR-T新适应症获FDA支持。百时美施贵宝与2seventy bio开发的BCMA CAR-T疗法Abecma(idecabtagene vicleucel)获FDA肿瘤药物咨询委员会(ODAC)推荐批准,用于既往已接受三类药物治疗后的复发或难治性多发性骨髓瘤(R/R MM)。在III期KarMMa-3临床中,Abecma较标准治疗使疾病进展或死亡风险降低51%(mPFS:13.3个月vs4.4个月)。2021年3月,Abecma已获得FDA首批,成为首款BCMA CAR-T疗法,用于治疗已接受过四线及以上治疗的R/R MM患者。
3.Citius公司IL-2R靶向药美国报BLA。FDA受理Citius公司靶向IL-2受体的重组融合蛋白Lymphir(denileukin diftitox)提交的生物制品许可申请(BLA),用于治疗复发或难治性皮肤T细胞淋巴瘤(CTCL)经治患者,PDUFA日期为今年8月。在Ⅲ期研究中,Lymphir经独立审查委员会(IRC)评估的客观缓解率(ORR)达到36.2%(95% CI:25.0%,48.7%),研究者评估的ORR为42.3%(95% CI:30.6%,54.6%)。
4.GSK妇科肿瘤组合疗法Ⅲ期临床积极。葛兰素史克PD-1抑制剂Jemperli(dostarlimab)联合化疗、以及在维持期使用Jemperli加PARP抑制剂Zejula方案,在治疗原发性晚期或复发性子宫内膜癌的Ⅲ期临床RUBY中达到了主要终点。与化疗相比,Jemperli组合显著提高了总体患者群体和MMRp/MSS患者亚群的无进展生存期(中位PFS分别为14.5个月vs8.3个月,14.3个月vs8.3个月),疾病进展或死亡风险分别降低40%和37%。此外,药物安全性良好。GSK计划今年上半年向FDA递交监管申请。
5.AZ妇科肿瘤组合疗法最新数据积极。阿斯利康PD-L1抗体Imfinzi(度伐利尤单抗)联合含铂化疗治疗晚期或复发子宫内膜癌,以及使用Imfinzi联合Lynparza维持治疗的III期临床DUO-E达到了多个关键次要终点。Imfinzi+Lynparza组合较标准治疗能显著延长患者总生存期(OS)以及中位缓解持续时间(中位DoR:21.3个月vs7.7个月);在错配修复完善(pMMR)亚组中,该组合显著延长中位DoR(18.7个月vs7.6个月),使疾病第二次进展或死亡风险(PFS2)降低32%。详细结果公布于SGO2024年会上。
6.帕金森病皮下制剂见刊《柳叶刀》子刊。田边三菱制药在《柳叶刀》子刊The Lancet Neurology上发表了新型皮下输注左旋多巴/卡比多巴(LD/CD)液体制剂ND0612治疗晚期帕金森病(PD)患者的关键Ⅲ期试验BouNDless积极结果。每天持续24小时皮下输注ND0612与口服速释(IR)LD/CD相比,可使患者处于“ON”时间增加了1.72小时,且没有出现运动障碍,改善具有统计学意义(p<0.0001)。该项研究还达到了四个次要终点。ND0612的安全性与口服护理标准LD/CD的安全性一致。
医药热点
1.诺华斥资在新加坡扩厂、增员。3月15日,诺华公司表示其位于新加坡的生物制药生产工厂耗资2.56亿美元的扩建工程已经破土动工,扩建后的工厂将重点生产治疗性抗体药物,为全球患者提供突破性治疗。扩建后的工厂预计将于2026年初投入运营,该工厂现在每年生产140个批次,相当于900万个成品剂量,扩建后的工厂产量将增加一倍以上,扩建后的工厂将创造100个高技能的新工作岗位。
2.安徽省:扩大农村订单定向免费医学生培养规模。近日,安徽省印发《关于进一步深化改革促进乡村医疗卫生体系健康发展的实施意见》,就加快县域优质医疗资源扩容、健全优质高效的乡村医卫体系提出14项具体措施。根据《实施意见》,增加乡村医疗机构儿科、口腔等紧缺人才供给,逐步扩大农村订单定向免费医学生培养规模,到2025年,村医中具备执业(助理)医师资格的人员比例提高到45%左右,逐步形成以执业(助理)医师为主体、全科专业为特色的乡村医疗卫生服务队伍。
3.英国研发出无创肠癌诊断新方法。英国癌症研究中心与格拉斯哥大学的联合研究团队日前研发出一种无创的肠癌诊断创新方法,可以在不进行侵入性手术的情况下诊断肠癌,降低肠癌发生率。与肠镜活检的传统肠癌诊断方法不同,研究人员利用PET扫描技术,通过影像学检查手段,可有效监测患者身体内部的三维图像,并可在治疗期间多次对患者进行扫描,实时监测病情发展情况。
评审动态
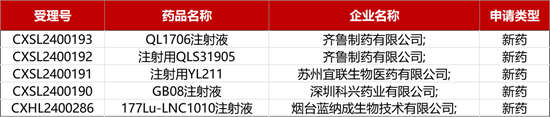
1. CDE新药受理情况(03月19日)
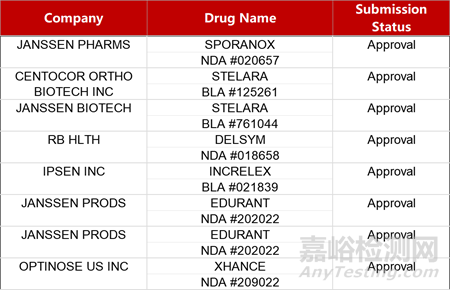
2. FDA新药获批情况(北美03月18日)