摘 要 / Abstract
新修订《药品管理法》全面实施药品上市许可持有人(MAH)制度,并将其作为基本制度、核心制度贯穿《药品管理法》。本文系统梳理了MAH 及相关主体在药品全生命周期全环节享有的权利、应当履行的积极责任及应当承担的消极责任,并以药品委托生产为例,分析了MAH 及相关主体责任义务落实情况,为MAH 及相关主体明晰自身的主体责任、落实相关义务提供参考,以保障药品质量安全。
The implementation of the newly revised Drug Administration Law comprehensively incorporates the system of marketing authorization holder (MAH) and positions it as a foundational and central element within the framework of the law. This article systematically examines the rights, proactive responsibilities, and passive obligations enjoyed and assumed by MAH and relevant entities throughout the entire pharmaceutical lifecycle. Using drug contract manufacturing as an illustrative case, it scrutinizes the implementation of responsibilities and obligations by MAH and relevant entities. The aim is to provide guidance for clarifying primary responsibilities and fulfilling relevant obligations, ensuring the quality and safety of pharmaceuticals.
关 键 词 / Key words
药品上市许可持有人 ;相关主体;主体责任;责权利分析;委托生产
marketing authorization holder; relevant entities; main responsibility; analysis of responsibilities and rights;
2019 年修订的《药品管理法》全面实施药品上市许可持有人(marketing authorization holder,MAH)制度,并将其作为基本制度、核心制度,贯穿于《药品管理法》。由MAH 将产品推向市场,对药品的安全性、有效性、质量可控性负责,承担全生命周期的主体责任,其他主体基于环节承担相应的责任。新修订《药品管理法》实施后,相关系列规章、规范性文件进一步明确规定了MAH 及相关主体的责任及权益。本文系统梳理MAH及相关主体的责权利关系, 为MAH 及相关主体更好地落实主体责任提供参考,以实现全面保障药品质量安全。
1、MAH 及相关主体享有的权利
《药品管理法》明确了MAH享有的权利。对于药品研制、生产、经营、使用等环节主体,基于环节从事相应的活动,并未明显新增权利。MAH 主要具有以下4 项权利[1]。
(1)MAH 可以将产品推向市场。无论MAH 为药品生产企业抑或是研制机构,均可以自主将产品推向市场,并对药品的安全性、有效性、质量可控性负责。这也是区别于“捆绑制”管理下MAH 最核心、最基本的权利。
(2)MAH 可以选择自主生产,也可以选择委托生产。MAH制度实施前,委托生产必须发生在药品生产企业之间、必须在产能不足的条件下进行。MAH 制度实施后,无论是上市申请时,或者产品上市后,MAH 均可以选择委托生产。MAH 自行生产应当取得药品生产许可证,委托生产应当委托符合条件的药品生产企业。MAH 与受托方之间应当签订委托协议和质量协议,约定双方的权利、义务。
(3)MAH 可以选择自行销售,也可以委托销售。MAH 制度下,当MAH 具备从事药品经营活动应当具备的条件时,可以自行销售持有的药品;当MAH 委托销售时,应当委托药品经营企业。MAH 与受托方之间应当签订委托协议和质量协议,约定双方的权利、义务。
(4)MAH 可以转让药品上市许可。MAH 制度下, 进一步明确了药品上市许可的物权归属。MAH 可以依据《药品上市后变更管理办法(试行)》[2] 的规定,依法转让药品上市许可,由受让方对转让后药品的安全性、有效性、质量可控性负责。
2、MAH 及相关主体应当履行的积极责任
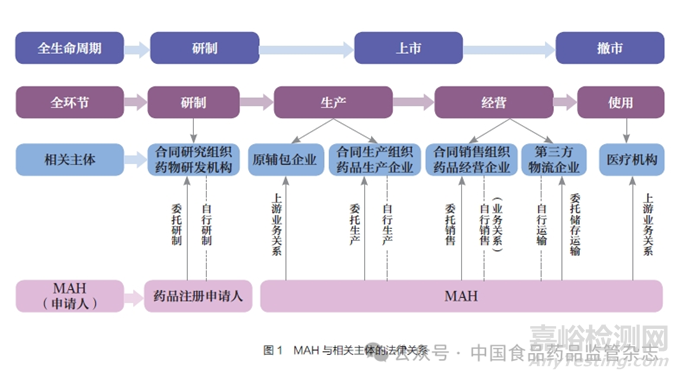
2.1 MAH 及相关主体的法律关系
法律关系即法律规范在调整人们的行为过程中所形成的具有法律上权利义务形式的社会关系。MAH 制度下,MAH 与相关主体的法律关系主要为上下游业务关系和委托合同关系。
(1)在传统模式下,当MAH自行研制、生产、销售时,MAH与相关主体为上下游业务关系。此时MAH 需要遵循药品研制、生产、经营等环节责任,同时还应当履行对上下游供应商的定期审计义务,确保上下游供应商满足全流程追溯、药物警戒等要求,还应要求供应商持续向MAH 反馈药品质量缺陷、投诉信息,并协助药品召回管理等。
(2) 在委托模式下,MAH采用委托研制(此时为药品上市许可申请人)、生产、销售时,MAH 与相关主体之间主要为委托合同关系,如图1 所示。委托合作前,MAH 应当对受托方的质量保证能力、风险管理能力进行评估,签订委托协议和质量协议,明确双方的责任义务。委托过程中,MAH 应当结合受托方质量管理体系情况、履行协议约定义务情况等,基于风险加强对受托方的管理,定期开展现场审核,确保持续合规。
2.2 MAH 应当具体履行的积极责任
在赋予MAH 政策红利的同时,《药品管理法》也对MAH 落实全生命周期、全过程主体责任提出了新要求。此外,2022 年12 月,国家药监局发布《药品上市许可持有人落实药品质量安全主体责任监督管理规定》[3],对MAH 全生命周期质量管理的要求进行了抽提、整合与系统化,以指导督促MAH 尽责履职,依法落实质量主体责任。
具体而言,MAH 应当从质量管理体系搭建及关键岗位人员配备、全过程质量管理要求、内部质量管理机制构建3 个层面落实全生命周期主体责任。
(1)搭建质量管理体系并配备关键岗位人员。MAH 应当建立健全药品质量管理体系,涵盖药品非临床研究、临床试验、生产经营、上市后研究、不良反应监测及报告等全生命周期,并持续改进质量管理体系,确保所生产的药品符合预定用途和注册要求。此外,机构与人员是MAH 质量管理体系搭建的核心。MAH 应当设立职责清晰的管理机构,配备与生产经营规模相适应、数量足够、具有相应资质的管理人员;设置独立的质量管理部门,履行全过程质量管理职责。关键岗位人员包括企业负责人、生产管理负责人、质量管理负责人、质量受权人、药物警戒负责人,其中企业负责人、生产管理负责人、质量管理负责人、质量受权人应当为全职人员。
(2)落实全生命周期、全过程质量管理要求。MAH 应当落实全生命周期、全过程质量管理要求,建立并实施药品追溯制度、药物警戒制度、药品召回制度;应当严把原辅包供应商审核关、生产检验放行关、上市放行关、储存运输关;应当加强上市后管理,建立药品上市后变更控制体系,制定药品上市后风险管理计划,完善药品安全事件处置方案,建立短缺药品停产报告制度。当MAH 采用委托生产、委托储存运输的,应当加强对受托方的管理,定期审核受托方的质量管理体系,确保质量管理体系的衔接性和持续合规。
(3)MAH 应当加强内部质量管理机制构建。MAH 应当构建“每批管控、季度分析、年度报告、定期自检或内审、持续培训”的质量管理机制,持续改进药品质量管理体系。具体而言,MAH 应当确保每批放行的产品生产、检验过程合规,偏差、变更以及潜在的质量风险均已得到调查和处理;应当结合产品风险定期组织对生产管理、质量管理等情况的回顾分析,原则上每个季度不少于一次对重复性风险和新出现风险的研判;应当指定专职人员负责年度报告工作,持续完善内部报告管理制度;应当定期进行自检或者内审,监控药品质量管理规范实施情况,确保质量体系的持续适用和有效;应当持续开展培训,定期评估培训效果,确保所有人员持续具备相应的知识和技能。
2.3 相关主体应当具体履行的积极责任
药品研制、生产、经营、使用环节等相关主体应当遵循相应环节的管理要求,持续符合《药物非临床研究质量管理规范》《药物临床试验质量管理规范》《药品生产质量管理规范(2010 年修订)》《药品经营质量管理规范》等规定,确保合规。受托从事药品研制、生产、经营活动时,应当履行协议约定的义务, 接受MAH 的定期审核,并按照审核发现的缺陷落实整改,积极采取相应的纠正和预防措施。受托方发现重大质量问题,应当立即向委托方和所在地药品监督管理部门报告,并主动采取风险控制措施。
3、MAH 及相关主体应当承担的消极责任
消极责任指应当由当事人承担的消极法律后果,包括民事责任、行政责任和刑事责任。
3.1 民事责任
根据《民法典》《药品管理法》规定,因药品质量缺陷致人损害,受害人可以向MAH、生产企业请求赔偿,也可以向经营企业、医疗机构请求赔偿。首先接到受害人赔偿请求的一方,应当承担先行赔付的义务,此后再依法追偿。即对外,MAH、生产企业、经营企业、医疗机构依法承担连带责任,并且实行首负责任制;对内,依据《民法典》《产品质量法》等划分各自的责任。值得注意的是,MAH 作为事实意义上的生产者,应当对产品缺陷致人损害承担无过错责任,其中《产品质量法》规定的法定免责事由除外,包括“未将产品投入流通的;产品投入流通时,引起损害的缺陷尚不存在的;将产品投入流通时的科学技术水平尚不能发现缺陷的存在的”三类情况,即狭义的药品不良反应应为产品投入流通时尚不能发现的缺陷,属于法定免责事由。
3.2 行政责任和刑事责任
在行政责任和刑事责任方面,不存在连带之说法。针对行政责任,MAH、生产企业、经营企业、医疗机构都应当基于《药品管理法》《药品注册管理办法》《药品生产监督管理办法》《药品经营和使用质量监督管理办法》等药事法律规章中规定的责任义务承担相应的行政责任;针对刑事责任,MAH、生产企业、经营企业、医疗机构应当基于《刑法》的规定,在满足犯罪构成要件的情况上,承担相应的刑事责任。需要注意的是,当MAH 和受托生产企业、经营企业之间为委托关系时,MAH 应当履行对受托方的监督义务,即“管理责任”,在违反上述“管理责任”的情况下,MAH 可能需要承担药事法律规章中对应的行政责任,也可能涉嫌《刑法》中规定的帮助犯。
4、MAH 及相关主体责任落实现状及相关思考——以药品委托生产为例
4.1 委托生产过程中MAH 与受托方的责权利分析
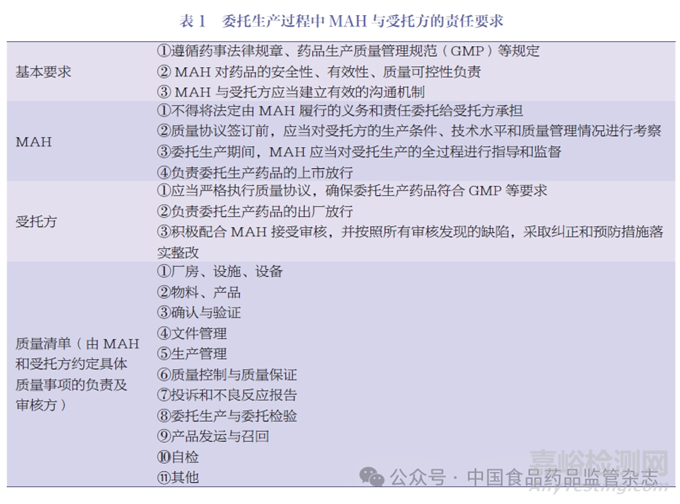
MAH 制度下,药品委托生产进一步放开,即MAH 可以选择自行生产,也可以委托生产。基于药品委托生产管理的重要性,《药品管理法》进一步要求国务院药品监督管理部门加强行政指导,发布药品委托生产质量协议相关指南,指导、监督MAH 和受托生产企业履行药品质量保证义务。随后国家药监局正式发布了《药品委托生产质量协议指南(2020 年版)》《药品委托生产质量协议模板(2020 年版)》,其详细规定了MAH、受托方的基本要求,见表1。
4.2 委托生产过程中MAH 与受托方责任落实情况
现阶段药品委托生产实际执行中尚存在以下几点问题。
4.2.1 相关政策执行中精细化管理有待进一步提高
《药品管理法》从夯实MAH的主体责任、保障药品质量安全的角度,要求执行生产放行和上市放行双放行管理,然而,其一,当MAH 自行生产时,是否需要双放行,实践执行中不够明确;其二,当MAH 和受托生产企业为执行同一质量管理体系的集团公司或者为长期紧密合作的合作伙伴时,双放行管理是否可以适当优化有待进一步探讨[4]。再者,在放行标准方面,《药品生产监督管理办法》规定:药品生产企业应当建立药品出厂放行规程,明确出厂放行的标准、条件,符合标准、条件的,经质量受权人签字后方可出厂放行。MAH 应当建立药品上市放行规程,对药品生产企业出厂放行的药品检验结果和放行文件进行审核,经质量受权人签字后方可上市放行。然而实践中关于MAH 的上市放行审核标准执行不一,例如部分MAH在上市放行时仅审核受托方的放行记录即签字放行,部分MAH则对受托方的批记录、偏差管理文件进行详细审核后签字放行等。
4.2.2 MAH 自身管理能力有待加强
MAH 制度下,研发机构、药品经营企业通过获得B 类药品生产许可证均可以成为MAH,但其中部分MAH 缺乏对产品研发信息、工艺条件的了解,可能造成研发到生产阶段的技术转移问题;部分MAH 缺乏质量管理经验,存在对药品生产企业过度指挥、过度干预等情况。另外,部分MAH 配备的关键人员缺乏相关经验、人员培训不到位、岗位变更频繁,还存在质量管理及药物警戒人员配置较少、兼任情况较多、难以有效履行相关职责等现象[5-6]。《药品管理法》首次从法律层面明确了质量受权人的放行职责,但实践中质量受权人存在准入标准较低、质量管理水平较低、身兼数职、流动频繁等情况,造成了其能力不足、话语权受限等问题[7]。
4.2.3 MAH 与受托方质量管理体系衔接不够畅通
目前,我国MAH 制度执行尚处于初级阶段,MAH 和受托方质量管理体系存在一定的缺陷和衔接性不足等问题。例如,没有明确放行管理规程、没有定期对受托方进行现场考核、缺少对受托方监控的方式[8]、未制定与受托企业进行质量信息沟通及处置的管理规程;未根据偏差的风险规定偏差发生双方的通知时限、沟通程序;未规定MAH 在接到受托生产企业变更申请后的处理流程等。对于受托方而言,针对如何将双方质量协议中约定有特殊要求的事项纳入其质量管理体系方面存在不足,包括偏差审批、变更控制、检验结果偏差(OOS)结果处理及上市放行等质量事项。这也导致MAH 与受托方文件管理体系脱节,未明确各自在质量管理事项中的参与程度和批准流程,双方文件各行其是,对相同问题的处理流程不统一。例如,部分MAH 文件规定生产过程中发生偏差的,需开展偏差调查形成调查报告,调查报告经委托方审核签字后方能关闭,但受托方的偏差管理规定未对委托方职责进行规定;部分MAH 规定按照变更控制级别确定审核程度,但受托方文件未进行相关规定[9]。
4.2.4 其他方面
《药品委托生产质量协议指南(2020 年版)》从我国国情出发,对委托生产中的质量协议签订与执行进行了详细规定,为MAH 和受托方开展委托生产活动提供了良好的指导。但目前,各方反映该指南存在法律地位不清晰,在委托生产签订质量协议时,双方不确定是否必须依照该指南起草质量协议。此外,该指南规定的部分内容与实践可能存在一定的冲突,例如该指南规定MAH 应负责物料供应商的选择、管理和审核,但实践中,相较于MAH 特别是研发机构的MAH,大型受托生产企业对不同委托方共用物料更为熟悉,其可以提供物料供应商合格目录,由MAH进行审核。
4.3 相关建议
MAH 制度的精髓在于通过专业化分工和协作实现资源优化配置[10]。基于现阶段我国MAH 制度执行时间尚短,MAH 与受托企业仍然存在相关不足的情况,笔者探索性地提出几点建议,以期为相关部门完善MAH 制度提供参考。
4.3.1 持续提升MAH 的质量管理能力
MAH 应当主动提升质量管理能力,配备符合要求的、足够数量的人员,加强对产品、工艺的理解;应当认真分析自身持有品种全生命周期中存在各种风险要素,充分考虑与产品质量相关方(受托生产企业、药品经营企业、监管部门)的衔接、互动、监管等需求,不断完善自身的质量保障体系、提升质量管理水平。各省(自治区、直辖市)也应当进一步细化对B 证MAH 的资质要求,组织能力提升培训班或者经验交流会,为MAH 提供经验交流平台。针对质量受权人,应当细化质量受权人的资质类别(例如分为化学药品、生物制品、中药等),重视质量受权人的继续教育,督促质量受权人持续学习和提升。
4.3.2 完善MAH 与受托方之间的沟通交流机制
在药品委托生产活动中,MAH 与受托方之间有效的协作和沟通交流至关重要。MAH 和受托方应当细化质量协议中质量事项的责任分工。当药品注册申报信息发生变更、发现质量风险时,MAH 应当及时通知受托方。受托方自身也有责任积极主动地识别潜在质量问题,向MAH 报告,并展开质量事故调查、风险分析、沟通和评估等系列举措。这种信息传递的双向性有助于不断改进产品工艺性能、质量状态以及MAH 与受托方质量管理体系的衔接性。除此之外,MAH 与受托方可以定期举办质量交流活动,共同讨论药品委托生产中常见风险、潜在隐患及解决方案。
4.3.3 细化相关管理规定
随着MAH 制度的推行,相关管理规定、MAH 与受托方之间责任义务的划分及落实等均需要在实践中进一步探索、完善。例如,在双放行管理方面,长期而言针对集团内委托生产,可探索适当简化放行程序,明确实行基于风险的上市放行管理;针对《药品委托生产质量协议指南(2020 年版)》,应当明确指南的指导性地位,同时允许企业适当调整指南事项,包括在物料供应商管理方面可以由具备成熟质量体系的受托方提供部分共用物料供应商目录供MAH 审核等,以更好地适应实际。
5、结 语
MAH 制度的实施,激发了医药行业创新活力、优化了医药行业资源配置。作为MAH,在享受政策红利的同时,更应当主动建立健全质量保障体系,加强对受托方的管理;应当具有主人翁意识、责任意识,积极承担药品全生命周期、全过程质量管理主体责任,形成“一方牵头、多方共担”的良好局面,切实履行对全过程相关主体的管理义务,保证药品质量安全。
参考文献
[1] 谢金平, 孙圆圆, 彭楠, 等. 药品上市许可持有人(MAH)制度对现行监管制度的影响及衔接建议[J]. 中国卫生政策研究,2018,11(12):1-6.
[2] 国家药品监督管理局. 国家药监局关于发布《药品上市后变更管理办法(试行)》的公告(2021 年第8 号) [EB/OL]. (2021-01-13) [2023-09-28].https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/20210113142301136.html.
[3] 国家药品监督管理局. 国家药监局关于发布《药品上市许可持有人落实药品质量安全主体责任监督管理规定》的公告(2022 年第126 号)[EB/
OL]. (2022-12-29) [2023-09-28].https://www.nmpa.gov.cn/directory/web/nmpa/yaopin/ypggtg/20221229195805180.html.
[4] 邵蓉, 谢金平. 再谈我国国情下药品上市许可持有人制度[J]. 中国医药导刊,2022,24(8) :735-739.
[5] 张书卉. B 类药品生产许可证核发检查常见问题分析[J]. 上海医药,2022,43(3):63-66.
[6] 胡士高, 窦颖辉, 王浩. 安徽省药品生产企业质量受权人结构现状调研分析[J]. 安徽卫生职业技术学院学报,2020,19(1):1-3.
[7] 应宏锋. “药品质量受权人制度” 的思考与实践:激发药品生产企业落实主体责任是监管工作的 “牛鼻子”[J]. 中国食品药品监管,2019(6):10-15.
[8] 颜若曦, 曹轶, 俞佳宁, 等. 对药品上市许可持有人检查工作的调研分析[J]. 中国药物评价,2022,39(1):83-86.
[9] 马艳红. 对MAH 委托生产的检查重点及监管难点分析[J]. 药学与临床研究,2022,30(2):184-186.
[10] 邵蓉, 谢金平. 变革中持续探索 探索中立足国情:再谈我国药品上市许可持有人制度[J]. 中国食品药品监管,2021(6):78-85.