根据药品管理法和新版的GMP指南的指导精神和要求,全生命周期方法的概念已经开始逐渐融入到我国各个方面的状态要求中。所谓的全生命周期方法是指一个方法从建立、成型、应用以及到后期的方法变更或者提升的一个动态循环的过程。USP[1]通则1220“分析方法生命周期”在2022年5月1日正式生效。该通则为分析方法开发设定了生命周期方法,简化了对分析方法进行批准后变更的过程。那么我们应该如何运用全生命周期方法去建立一个分析方法的生命周期呢?首先让我们来了解几个建立分析方法生命周期的概念。
1、分析目标概况(ATP)[2]:对能够满足分析检测预期目的和预期性能标准的性能特性的前瞻性总结。
2、关键质量属性(CQA)[3]:指产品的物理、化学、生物或微生物特性应在适当的限度、范围或分布之内,以确保预期的产品质量。
3、既定条件(ECs)[4]:是确保产品质量所必须的具有法律约束力的信息。EC的任何变更都必须提交给监管机构。
4、方法可操作设计区域(MODR)[2]:分析方法参数的范围,在该范围内操作可达到分析方法的性能标准,从而确保检测结果的可靠性。
5、分析方法验证策略[2]:分析方法验证策略描述了如何选择用于验证的分析方法性能特性。在策略中,开发研究(例如,使用MODR或PAR)期间和系统适用性试验(SST)期间收集的数据可用于验证,并且可制定涵盖在MODR/PAR内的参数未来波动的实验方案。
6、经证实的分析方法可接受范围(PAR)[2]:指一个分析方法参数的范围。在保持其他参数不变的同时,使分析检测结果符合相关性能标准的分析方法参数的表征范围。
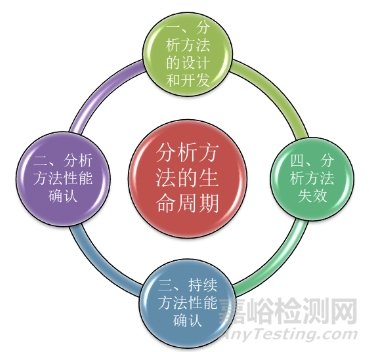
在以上概念中,其中ATP(分析目标概况)是生命周期方法的基本组成部分。ATP的标准是建立在分析方法的预期用途之上的,对于定量方法,ATP则通常根据目标测量不确定度,即报告结果中的最大可接受不确定度来规定分析方法产生的检测结果所需的质量。所以,建立一个分析方法的生命周期,ATP应作为关键步骤贯穿始终。分析方法的生命周期可以分为四个阶段。如下图所示。
接下来,我们对分析方法生命周期的三个阶段展开进行一个详细的描述。
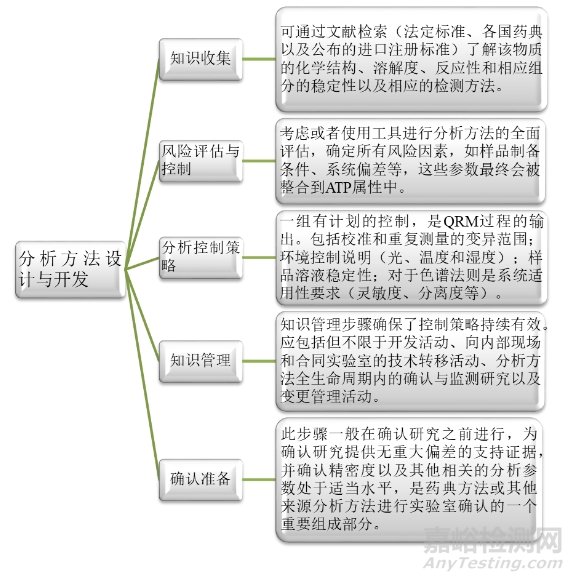
首先是第一阶段:分析方法的设计与开发。顾名思义,此阶段主要包括:知识的收集、风险评估与控制、分析控制策略、知识管理和确认准备等。
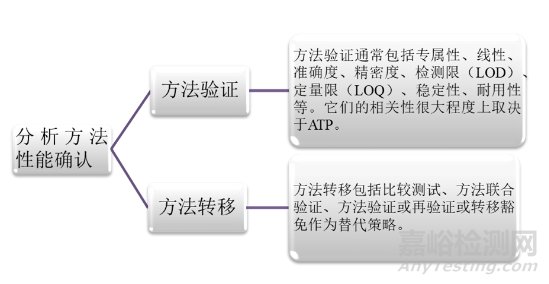
其次是第二阶段:分析方法性能确认。主要包括方法验证和方法转移两个部分。方法验证的目的是确认该方法将按预期运行,并且能满足先前定义的ATP的标准。而方法转移则是因为在产品从开发、扩大、制造、生产和投产到批准后的生命周期中,要满足将分析方法从研发实验室转移到生产实验室的要求。方法转移过程中,应当进行严谨的风险评估,来确定需要进行对比的参数。2020年版《中国药典》四部指导原则9099[5]、9101[6]和9100[7]分别对分析方法的确认、验证和转移进行了详细的描述。
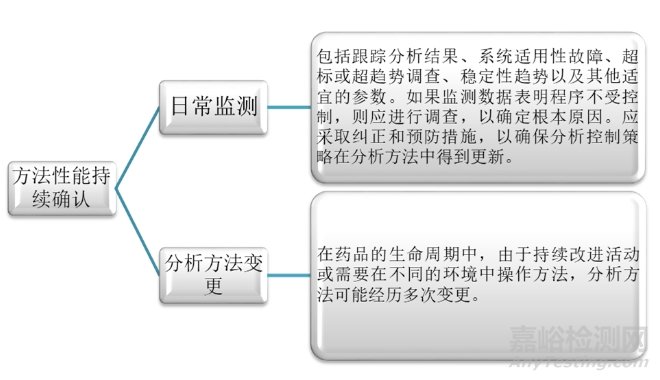
再次是第三阶段:持续方法性能确认。此阶段是分析方法生命周期中确保分析方法保持在受控状态,持续满足ATP标准的重要方面。主要包括日常监测和分析方法变更两个组成部分。因此,此阶段在ATP中被用作程序性能的参考点。
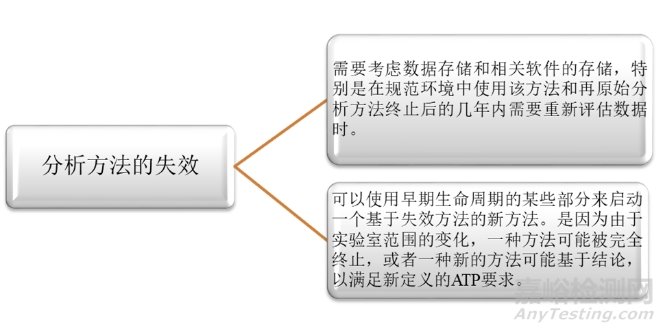
最后是第四阶段:分析方法的失效。作为分析方法生命周期的最后阶段,其终止也要遵循质量管理原则。其主要考虑以下两个方面。
参考文献
[1] 美国药典USP/NF,通则1220,分析方法生命周期.
[2] ICH指导原则,Q14分析方法开发.
[3] ICH指导原则,Q8药物研发.
[4] ICH指导原则,Q12药品生命周期管理的技术和监管考虑.
[5]2020年版中国药典,四部指导原则9099,分析方法确认指导原则.
[6]2020年版中国药典,四部指导原则9101,分析方法验证指导原则.
[7]2020年版中国药典,四部指导原则9100,分析方法转移指导原则.