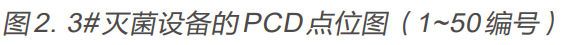环氧乙烷灭菌一直以来都是无菌医疗器械较为有效的灭菌方式,也是无菌医疗器械生产中至关重要的一个工艺过程。环氧乙烷灭菌可在低温环境下(例如55°C±10°C)进行灭菌,广泛应用于多数不耐高温、不耐湿的包装材料和医用高分子医疗器械灭菌。口罩的熔喷层经过驻极处理而带静电,具有粒子吸附作用。常用的辐照灭菌会破坏熔喷层的电荷结构,影响口罩的细菌过滤效率和颗粒过滤效率,而环氧乙烷灭菌并无此影响,在口罩灭菌中具有重要性和不可替代性[1]。
灭菌过程是无菌医疗器械生产中的一个特殊过程,过程确认可以证明这一过程能够持续且有效地生产出符合无菌保证水平要求的产品。由于灭菌设备之间存在差异,灭菌效果可能不同。因此,即使对于完全一致的灭菌过程,在不同灭菌设备上运行时,仍需要分别进行灭菌确认[2]。在日常生产中,单一柜体灭菌通常不能满足口罩的产能需求,而如果要用多台灭菌柜同时灭菌,需要多次验证工作,周期时间过长,不具有时效性。在应对紧急市场需求时,一方面要保证一次性使用医用外科口罩产能充足,另一方面又要保证其灭菌后的无菌保证水平。为了减少在其他灭菌设备中验证所需时间,本文依据YY/T 1268-2015 《环氧乙烷灭菌的产品追加和过程等效》,采用过程等效验证的方式来实现。
1.材料与方法
1.1一般材料
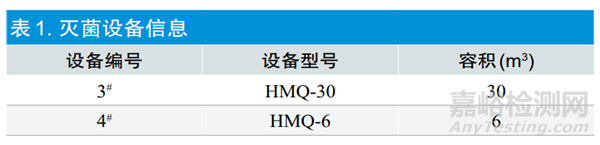
研究起止时间:2020年12月~2022年6月。灭菌设备为同一生产厂家,表1为本次确认所用的灭菌设备信息。灭 菌 剂 选 用 环 氧 乙 烷 混 合 气 体, 质 量 比 EO:CO2=30%:70%。灭菌确认微生物评估中灭菌负载产品为一次性医用外科口罩(生产厂家:天津市远东医材有限公司),微生物指示剂(Microbial Indicator,BI)采用枯草芽孢杆菌ATCC9372(D值3.0min,芽孢含量2.0×106cfu/unit)。将BI放入尺寸100mm×85mm,厚0.1mm的高密度全塑袋中密封,制成外部挑战装置(External Challenge Device,PCD)[3]。
1.2方法
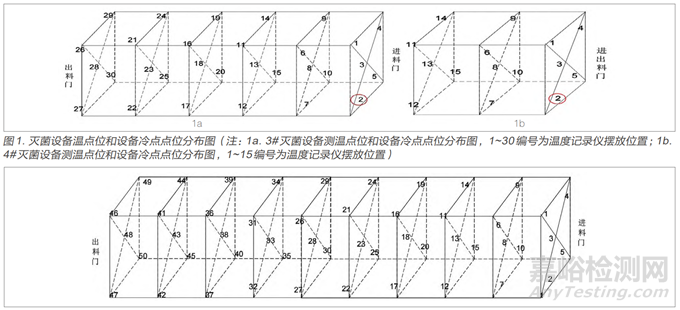
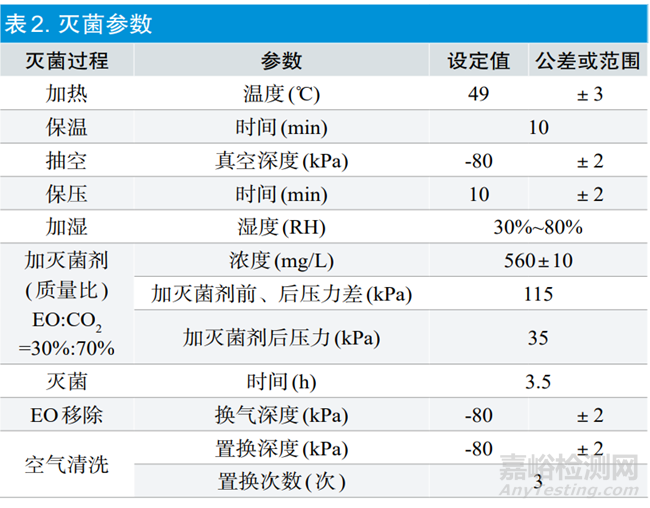
选择已经按照GB 18279.1-2015《医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》完成了安装确认和运行确认的3#灭菌设备和4#灭菌设备。按照YY/T 1268-2015 《环氧乙烷灭菌的产品追加和过程等效》中5.3过程等效确定。从设计和工程评估、过程分析和评估、微生物评估三个方面进行分析,评估经4#灭菌设备确认的灭菌参数是否可以等效到3#灭菌设备[4]。在过程分析和评估中,在3#灭菌设备空载状态下,分别进行各点位升温速率和温度分布测试分析。在灭菌设备空间中均匀放置温度记录仪,测温点位和设备冷点点位如图1所示(图中圈出点位为冷点)。
在微生物评估中,在3#灭菌设备中灭菌负载产品满载状态下,按照图2进行PCD摆放,采用表2中4#灭菌设备同样的灭菌参数进行灭菌。灭菌后对PCD中的BI进行无菌检测。
2.结果与分析
2.1设计和工程评估
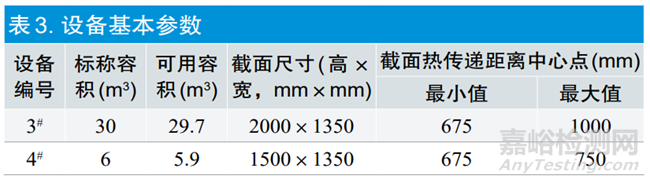
2.1.1灭菌设备基本参数
所用的3#与4#环氧乙烷灭菌设备均为同一厂家制造,标称容积不同,表3是两台灭菌设备基本工程参数。两台设备的截面尺寸,高度相差500mm,宽度一致,截面尺寸基本相似,长度是容积的变量,均采用六面体水循环加热。两台设备均采用单排托盘装载方式,在对灭菌产品加热方式上(辐射、传导、对流)从中心点到加热面的最短距离是675mm,最大距离是750~1000mm,距离相差不大。
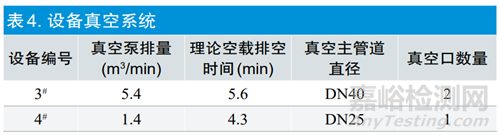
2.1.2真空系统
空载时理论排空时间是评估不同容积灭菌设备配置真空泵大小的依据,此参数直接影响抽真空的速率。表4中,按照真空泵的排量和灭菌设备的容积计算在相同压力下理论空载排空时间为4.3min和5.6min,两台设备的真空系统相差不大,在可接受范围内。
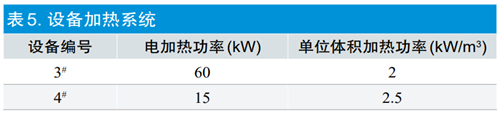
2.1.3加热系统
灭菌设备柜内灭菌产品加热和环氧乙烷气化器加热均由加热水箱提供热量,灭菌设备采用六面体保温设计,保温效果良好,循环水温度一般在50°C~55°C。表5中,两台设备单位容积加热功率在2~3kW/m3,单位容积加热功率2kW/m3足以满足柜内产品加热和环氧乙烷气化器加热的要求,两台设备加热控制均采用PID调节方式和自动控制系统,可以认为基本等同。
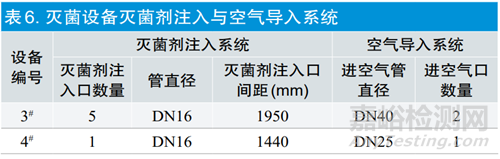
2.1.4灭菌剂注入和空气导入系统
分别对两台灭菌设备的灭菌剂注入管路、灭菌剂注入点位进行对比,系统配置信息详见表6。两台设备的灭菌剂注入管路均采用Φ8mm紫铜管,能够保证高压液态混合气体的流量基本稳定且充分气化、经过气化器后为直径DN16的不锈钢管。两台设备灭菌剂加注口间距在1440~1950mm,每个灭菌剂加注口所覆盖的空间相差不大,则灭菌剂进入产品的分布路径基本一致。灭菌剂注入、空气导入的点位数量和管道直径均按不同容积进行匹配,每个加注口的间距及所覆盖的范围和导入空气点位的速率也比较接近。
2.2过程分析和评估
对两台灭菌设备的升温速率、真空速率、灭菌剂注入速率三个过程参数进行过程分析和评估。
2.2.1升温速率分析
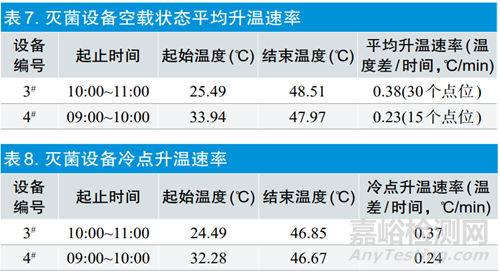
灭菌设备空载状态平均升温速率数据见表7,灭菌设备冷点升温速率见表8,3#灭菌设备平均升温速率和冷点升温速率均高于4#灭菌设备。从产品进入设备到暴露的过程中,3#可以使产品升温速率更高,更容易灭菌。
2.2.2真空速率分析
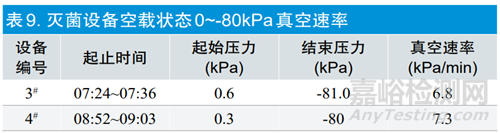
通过表9可以看出两台灭菌设备的真空速率基本相同。灭菌过程尤其是加湿前真空度对灭菌效果影响非常大,预真空的大小决定残留空气的多少,而残留空气可直接影响环氧乙烷气体、热量、湿气到达被灭菌物品的深层和腔体内部,从而影响产品暴露阶段的初始状态。此外,真空速率过快可能造成对被灭菌产品及其包装的破坏[5]。
2.2.3灭菌剂注入速率分析
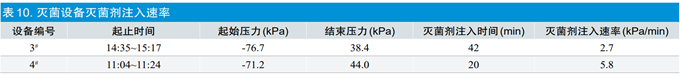
从表10的对比数据分析,本次评估中使用的灭菌剂为EO:CO2=30%:70%的混合气体,每瓶净重25kg(40L)[5]。3#灭菌设备需要加入大约4瓶灭菌剂,4#灭菌设备加入0.5瓶灭菌剂,加注灭菌剂过程中有更换气瓶停顿的影响,所以不同容积灭菌设备的加注灭菌剂速率计算值会有差别,但因采取了降低加注灭菌剂管径限制液体流量的措施,保证了环氧乙烷的气化效果,使得不同柜体的加注灭菌剂分布总体影响较小。等效评估中,在设计和工程评估通过后,通过对两台灭菌设备进行空载状态的温差分布和加热速率、真空速率、以及灭菌剂注入速率、时间综合分析评估,两台灭菌设备实施的过程评估,过程参数基本相似,可以进行微生物评估。
2.3微生物评估
采用同一灭菌负载产品(一次性医用外科口罩),同一厂家灭菌剂、同一厂家灭菌生物指示剂和相同的PCD,进行满载状态灭菌。3#灭菌设备运行经4#灭菌设备确认后的一个半周期参数,对放置的PCD进行无菌检测,结果全部灭活。
在等效评估中,影响灭菌产品生物负载水平的生产环境没有改变;生产设施和灭菌场所之间的距离相同,灭菌前的转运时间相同。因此,产品灭菌前的生物负载基本一致。在微生物评估过程中,运行了一个半周期,从试验的无菌检验报告,可以证明在已评估的设备内该灭菌过程有能力传递规定的最小无菌保证水平(SAL不超过10-6)。
在YY/T 1268-2015《环氧乙烷灭菌的产品追加和过程等效》5.3.4中规定,通过设计和工程评估、过程分析和评估、微生物评估,则证明这个过程是等效的,无须进一步的鉴定。综上分析,3#灭菌设备和4#灭菌设备对一次性使用医用外科口罩的灭菌过程等效。此灭菌过程等效是建立在以上三个不同层级评估的基础之上的,当灭菌设备发生较大变化(如可能影响设备运行参数的维修、更换部件等)时都要进行重新确认和评估。
3.讨论
此次评估针对的是一次性医用外科口罩产品做的环氧乙烷灭菌过程等效评估,该类产品材质和结构简单,多采用透气的纸塑包装。若对其他组成材料、结构或包装复杂的产品建立过程等效评估,如输液器、血液净化体外循环管路、植入类等产品,在进行微生物学评估时,应进行更全面和更严格的评估。此外,除评估最小无菌保证水平的传递,对于可能引起已鉴定的产品生物负载变化的因素也应予以评估,这些变化通常有以下几个方面:①制造环境变化,如生产车间洁净空调系统的改变;②灭菌场所的变化;③对于委托灭菌的生产企业,还应关注生产场地和灭菌场地之间运输距离以及运输条件(比如运输时间、季节引起的温度、湿度的不同)带来的影响[6]。
对于无菌医疗器械,产品无菌性至关重要。灭菌过程作为无菌医疗器械生产中的特殊过程,是企业生产过程控制和政府监管的重点。通过灭菌过程等效验证可以缩短灭菌确认所需的时间,减少重复性的确认工作,提高效率满足市场需求。但同时也要充分考虑其关键控制点,全面评估由此带来的产品风险[7]。
参考文献
[1] 白丹丹,李菲,李利娜,等.不同灭菌方法对医用口罩的性能影响[J].轻纺工业与技术,2020,49(10):7-9.
[2] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求:GB 18279.1-2015[S].2015.
[3] International Organization for Standardization. Sterilization of health—care products—Ethylene oxide—Requirements for the development, validation and routine controlof a sterilization process for medical devices: ISO 11135:2014[S].2014.
[4] 国家食品药品监督管理总局.环氧乙烷灭菌的产品追加和过程等效:YY/T 1268-2015[S].2015.
[5] 李伟松.影响环氧乙烷灭菌效果的因素[J].医疗保健器具,2005,12(Z2):53-56.
[6] 翟建红.影响环氧乙烷灭菌湿度的季节因素分析[J].护理研究,2014,28(12):1436-1437.[7] 唐剑,姚鹏.无菌医疗器械生产企业灭菌控制常见缺陷分析及监管要点梳理[J].中国食品药品监管,2019,17(10):41-45.