您是否想过如何确定涉及医疗器械的clinical investigation的监管途径?
让我们以已经获得 CE 认证的器械为例。
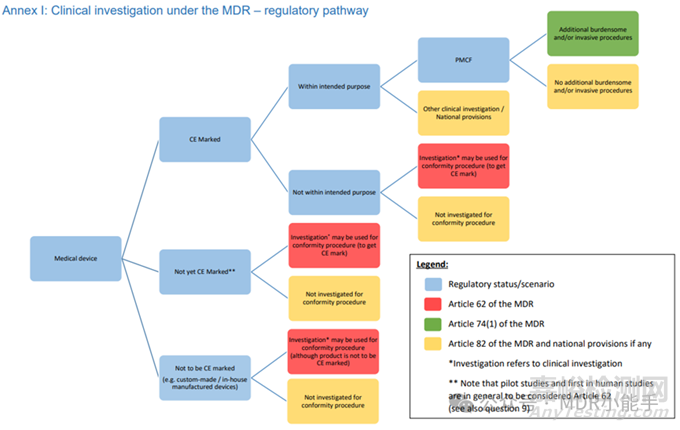
涉及CE认证医疗器械clinical investigation的监管途径可能很复杂。关键因素是器械的预期用途。将器械的original intended use与研究中的应用相一致至关重要。这种一致性是监管要求,也是clinical investigation planning的一个战略方面。
监管框架的路线图始于医疗器械协调小组文件 MDCG 2021-6 Rev. 1,尤其是附件 I(见下图)。
该文件中的问题 12 尤其具有启发性,它指导您评估与clinical investigation相关的预期用途。
这一点在上市后临床跟踪(PMCF)活动中变得更加重要。
对于可能会增加侵入性或繁琐程序的研究,复杂性会增加。
MDR第 74(1)条要求在这种情况下通知相关欧盟成员国。
确定这些程序的侵入性或繁琐程度是一个关键步骤,通常需要咨询欧盟相关临床机构。
如果您的研究不属于第 74(1)条规定的范围,或者器械的使用超出了规定的用途,那么每种情况都需要采取量身定制的监管方法。
在这种情况下,MDR 的具体条款和欧盟国家法规将成为您的指导原则。