新药开发过程中是否一定需要采用啮齿类和非啮齿类两个种属开展非临床毒理研究?是否采用其中一种种属获得的毒理学数据已经足够充分?有没有可能在药物开发不同阶段出现毒理种属减少的情况?先看下ICH M3(R2)、ICH S6(R1)、ICH S9的相关规定。
ICH M3(R2)在重复给药毒性研究部分有关于种属要求的描述“在两个种属中开展的动物毒理研究给药持续时间应该超过临床拟用时间”。
ICH S6(R1)在animal species/model selection部分也有描述,安全性评价应该在两个相关动物种属中开展。不过,如果生物制品仅在一个种属中具备生物学活性,仅开展一个种属的毒理研究也是可以接受的。此外,如果在短期重复给药毒性试验中采用两个种属开展了毒理研究,在科学合理的前提下(如药物在两个种属中的毒性表现类似),更长周期毒性试验也可以采用一个种属开展。
在ICH S6(R1)的addendum 2.1 general principles中还有相关描述,对于单克隆抗体或其它抗体类产品,如果靶点是外源性的,比如针对细菌或病毒的靶点,开展一个种属的短期重复给药毒性研究是可以接受的。
在ICH S6(R1)的addendum 2.2 one or two species部分的描述是,如果有两个药理学活性种属,短期重复给药(最多一个月给药周期)毒性试验必须在两个种属中开展。假如两个种属中的毒性表现类似或者可以从药物作用机制解释毒性结果,则更长周期毒理研究建议在一个种属中开展。除非说明选用非啮齿类动物的合理性,否则建议在啮齿类动物中开展更长周期毒性研究。如果只有一个药理学活性相关种属,则只在该种属中开展毒理研究也是合理的。
在ICH S6(R1)的addendum note2部分的相关描述,假如采用两个种属评估ADC产品的毒性,则需要在至少一个种属中单独评估,或伴随增加一个试验组,评价偶联毒素的毒性,仅需开展短期毒理研究即可。除非毒素在啮齿类动物中没有活性,通常啮齿类动物是首选。
ICH S9的general toxicology部分,对于小分子,一般需要开展啮齿和非啮齿类两个种属的毒理研究。在Q&A部分,关于ADC类产品有3个问题是与种属有关的。1)毒素或者连接子需要开展研究吗?回答是如果毒素或毒素-连接子从未进行过毒理表征,则需要在一个种属中开展单独的短期重复给药毒性研究,或者在ADC重复给药毒性研究试验中增设毒素或毒素-连接子试验组。这点与ICH S6(R1)中的要求是一致的。2)假如ADC与非临床种属的靶点均不结合,毒理研究如果开展?答复是仅在一个种属中开展ADC的毒理评价即可。3)通常是采用两个种属开展毒理研究,但对于ADC产品,有哪些场景适用于仅开展一个种属的毒理研究?答复是如果ADC中抗体部分仅结合人和非人灵长类靶点,则仅在非人灵长类中开展毒理研究即可。
小分子化药通常在两个种属中开展毒理学研究,生物药因相关种属原因则往往仅在一个种属开展。当然,如果啮齿类和非啮齿类都是相关动物种属,生物药也同样建议在两个种属中进行短期毒理研究。但更长周期毒性研究,在一定前提条件下,是可以仅在其中一个种属中开展的。这个条件指“两个种属短期重复给药毒性研究结果相似”,但这种描述是模糊的,实践过程中很难把握这个尺度。很多企业为了规避审评风险,或担心影响项目开发进度,依然默认选择在两个种属中开展更长周期毒理研究。
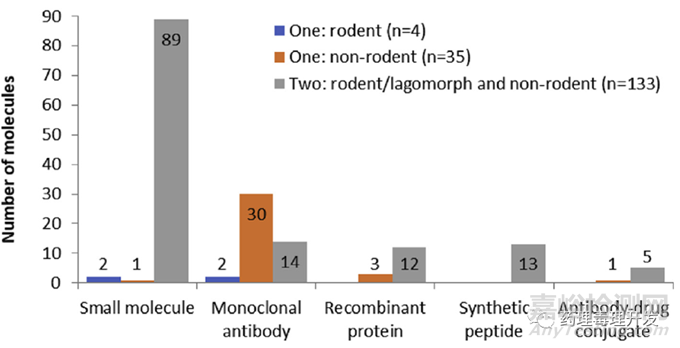
NC3Rs/ABPI工作组是由来自25家全球大药企、6家CRO、2家科研机构及4家监管机构组成的非临床专家团队。该工作组就毒理研究种属数量问题进行了调查,并公布了结果。主要统计了92个小分子化药,46个抗体,15个重组蛋白,13个合成肽,6个ADC,共计172个候选药物。
其中,133/172个候选药物采用两个种属开展毒理研究。39/172个候选药物仅采用一个种属开展了毒理研究,35个仅采用非啮齿类动物,4个采用啮齿类动物。仅采用非啮齿类动物开展毒理研究的大部分是抗体或融合蛋白。46个抗体类候选药物中,30个抗体仅采用非人灵长类开展毒理研究,仅选择啮齿类开展毒理研究的两个抗体药物,一个选择的转基因动物,另外一个选择了大鼠。重组蛋白中有3个仅在非啮齿类中开展毒理研究,全部选用的非人灵长类。
92个小分子中,89个开展了两个种属的毒理研究。其中83个啮齿类种属选择大鼠,5个选择了野生型小鼠,1个选择兔子。非啮齿类动物中,59个选择犬,29个选择非人灵长类,1个选择小型猪。14个采用两个种属开展毒理研究的抗体中,非啮齿类种属均选择的非人灵长类,啮齿类种属的选择是7个大鼠、3个转基因小鼠和2个野生型小鼠。12个两种属重组蛋白中,非啮齿类是10个选择非人灵长类、2个选择犬,啮齿类是9个选择大鼠,3个选择野生型小鼠。13个选择两种属的合成肽中,大鼠是主要的啮齿类种属(12个),1个采用了野生型小鼠,非啮齿类的选择犬和非人灵长类相当(7个犬、6个非人灵长类)。5个选择双种属的ADC中,全部采用非人灵长类作为非啮齿类种属,啮齿类中以大鼠为主(4个项目选择大鼠、1个选择小鼠)。
那么89个小分子、14个抗体、12个重组蛋白、13个合成肽、5个ADC,共计133个选择双种属开展毒理研究的候选药物中,有几个在后续毒理研究中改为单种属了呢?
答案是仅8个。8/133个候选药物从IND enabling阶段的两个种属,在后续阶段的毒理研究中减少为一个种属。1个小分子在临床试验前采用的大鼠和犬开展的毒理研究,临床阶段仅开展的犬的毒理研究。5个候选抗体中,2个从临床前的大鼠+猴,更长周期毒理研究仅采用大鼠,未开展猴毒理研究。3个从临床前的啮齿类+猴,更长周期毒理研究仅采用猴,放弃了啮齿类。2个ADC,早期开展过大鼠或小鼠的毒理,后续仅采用的非人灵长类开展的IND enabling毒理研究。看到这,其实已经比较清楚了,94%的药物在更长周期毒性试验中,依然沿用了双种属。如前文所讲,“两个种属短期重复给药毒性研究结果相似”,这种描述是模糊的,实践过程中很难把握这个尺度。很多企业为了规避审评风险,还是默认选择两个种属开展更长周期毒性研究。
但双种属开展支持晚期临床的非临床毒理研究的价值有多呢?能不能通过单种属得出双种属类似的结论呢?125/133个候选药物在后续毒理试验中依然采用了双种属开展毒理试验,其中122个对这一问题给出了反馈。81/122(66%)的药物可以通过单种属得出与双种属研究一致的结论。细分到各亚类分别是,56/85(66%)小分子、8/9(89%)单抗、7/12(58%)重组蛋白、8/13(62%)合成肽、2/3(67%)ADC。单抗的占比是最高的,但样本量偏少。可能与单抗药物的特点有关,特异性强,如果排除脱靶因素,单抗的毒性作用以药理作用放大为主,两个种属间的毒性表现和机制相似度高一些。不过,这些数据只代表了一些研究数字,具体到实操环节,各个药企的动作还是很诚实,绝大多数还是会选择两个种属开展后续的毒理学研究。
从这个调研结果可以看出,大部分小分子(89/92)采用双种属开展毒理研究,过半数抗体(32/46)采用单一种属开展毒理研究,重组蛋白、合成肽和ADC则以双种属为主,当然这只是代表样本数据,本质上选用单种属和双种属开展毒理研究,要从相关种属选择依据着手,基于试验数据进行选择。比较有意思的是,125/133的候选药物在短期重复给药毒性试验中采用的双种属,更长周期毒性试验中依然选用的双种属,是不能满足ICH建议的“两个种属中的毒性表现类似或者可以从药物作用机制解释毒性结果,则更长周期毒理研究建议在一个种属中开展”原则吗?细节不得而知,从概率角度看,更多的还是为了规避审评风险,避免因种属选择问题影响药物开发进度。企业也可以尝试就更长周期毒理种属选择问题跟监管机构进行沟通、咨询。毕竟多做费时、费力、费资源,也不符合“3R”原则,少做则引入注册风险。