Humacyte宣布完成可再生人工血管---HAV的2/3期血管创伤临床研究(V005),本项研究结果将作为注册资料向FDA提交生物制品许可证申请(BLA),预计在今年第四季度提交注册。如果HAV能够获得FDA批准,将开创人造血管的新时代---可再生时代,甚至为后续生物机制人造脏器奠定基础。
V005临床研究是一项针对血管创伤患者的单臂、开放标签、关键研究,在美国和以色列的一级创伤中心进行。研究主要疗效评估将基于四肢血管创伤患者30天通畅率。本项研究总共纳入68名患者,其中51例患者有四肢血管损伤,构成了主要疗效分析数据。具体研究结果将在本季度末发布。
除了V005临床研究外,还纳入俄乌战争中的真实性研究数据---总共19例血管创伤患者,Humacyte披露在治疗一些最困难和最容易感染的血管损伤方面疗效显著,尤其是在抗感染方面。随着国与国之间对抗和冲突加剧,有些地区热战将不可避免这就需要更多医治血管创伤的器械,可再生人工血管有可能将拯救无数受伤士兵和患者。这项真实性研究数据也将作为注册资料一部分提交给FDA。
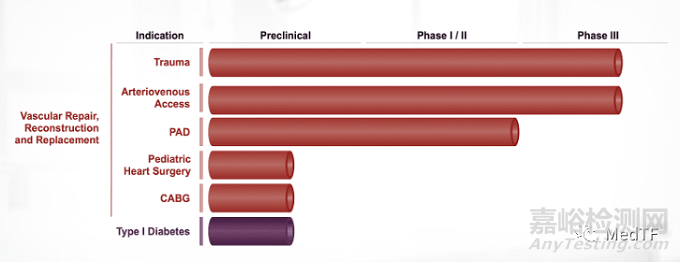
目前HAV已经在全球完成超过1000例临床植入,使用领域包括血管创伤、用于血液透析的动静脉(AV)通路和外周动脉疾病。HAV正处于针对多种血管应用的后期临床试验中,包括血管创伤修复、用于血液透析的AV通路(V007,2023年4月宣布注册完成)和外周动脉疾病(2023年1月宣布6年2期试验结果)。FDA有可能一次性批准多个预期用途,将为人工血管带来革命性变革。
HAV
HAV是人类脱细胞组织工程血管(human acellular vessels)简称,其不仅保留血管生物力学特征,同时剔除可导致免疫排斥反应的成分。
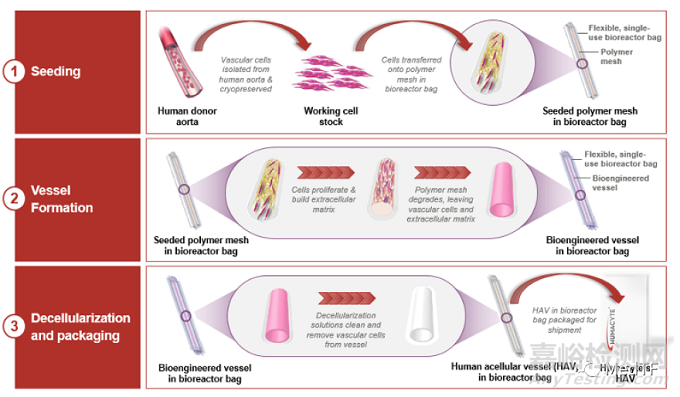
HAV的制造过程可分为:
先从人类供体获得血管细胞,然后对其进行组织培养,并且把细胞放在一个血管状的可降解支架上。细胞组织浸浴在营养液中生长,并不断延展从而获得真正的血管所具有的物理特性。
数周后,细胞生长并产生新组织,形成管状血管结构,而聚合物支架完全降解。
再将生物工程血管去细胞化以产生 HAV:一种细胞外基质,保留了血管的生物力学特征,但清除了可能诱导免疫反应的细胞成分。
Humacyte
Humacyte是由耶鲁大学Laura E. Niklason院士于2004年创立的创新医疗器械公司,其正在开发一个颠覆性的生物技术平台,以提供可普遍植入的生物工程人体组织和器官,旨在改善患者的生活并改变医学实践。
Humacyte开发和生产脱细胞组织,用于治疗各种疾病、损伤和慢性病。 Humacyte是人类无细胞血管(HAV)组合,目前正处于针对多种血管应用的后期临床试验,包括血管创伤修复、血液透析的动静脉通路和外周动脉疾病。冠状动脉旁路移植术、小儿心脏手术、1 型糖尿病治疗以及多种新型细胞和组织应用的临床前开发也在进行中。
其中,用于治疗终末期肾病患者血液透析(Arteriovenous Access)的 V006、V007 以及血管外伤(Trauma)的 V005 进展相对较快,已进入临床 Ⅲ 期试验。
Humacyte目前总计完成近7亿融资,巨额融资推动人类无细胞血管(HAV)快速发展。