摘 要
本文通过文献分析,对比内地(以广东省为例)与香港、澳门在中药注册行政管理体系、法律法规体系和注册分类等方面的异同。结合粤港澳大湾区药品医疗器械监管创新发展工作实践,提出支持粤港澳三地中药产业协同发展,并以港澳为“窗口”促进内地中药产品国际化、现代化,推动内地医疗机构制剂成果转化的思考和建议。
粤港澳大湾区建设,是习近平总书记亲自谋划、亲自部署、亲自推动的重大国家战略。2019年2月,中共中央、国务院印发《粤港澳大湾区发展规划纲要》[1]。2020年9月,国家市场监管总局、国家药监局等八部门印发《粤港澳大湾区药品医疗器械监管创新发展工作方案》[2],创新药品医疗器械监管方式,整合监管资源,促进医药产业在粤港澳大湾区融合发展,更好地满足粤港澳大湾区居民用药用械需求,保障用药用械安全,塑造具有创新活力的健康湾区。
2022年1月1日,澳门药物监督管理局正式成立,《中药药事活动及中成药注册法》同日生效,并先后发布了25项关于在澳门开展中成药注册、生产、流通等药事活动的技术规范。至此,内地与香港、澳门均已建立较为完善的中药注册管理体系,推动三地监管融合,已具备良好的法律体系和行政体系基础。在粤港澳大湾区发展中医药,是助力健康中国,塑造健康湾区的重要举措。本文通过对比内地(以广东省为例)与香港、澳门中药注册管理机构的异同,比较三地中药注册法律法规体系的特点,重点分析三地中药注册管理机制的差异,提出粤港澳三地中医药产业融合创新发展的思考和建议,助力内地优质中药产品通过港澳“走出去”。
一、中药注册管理机构对比
(一)内地中药注册行政管理体系
1.国家级中药注册行政管理体系
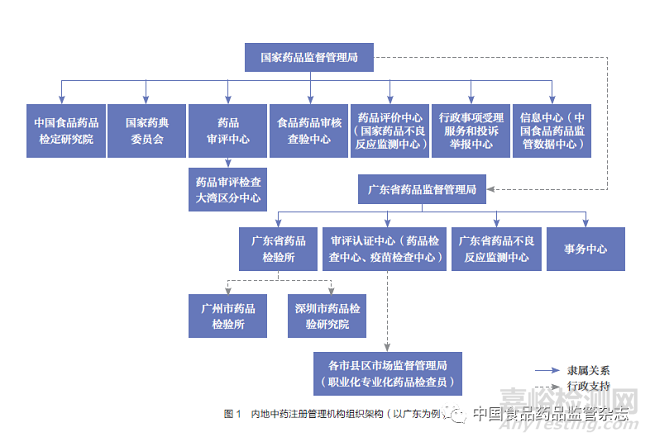
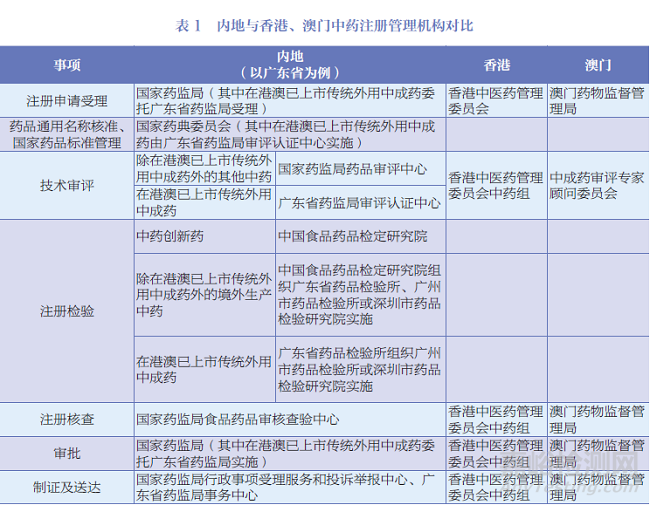
国家层面的药品(含中药、民族药,下同)注册管理事项由国家药品监督管理局(以下简称国家药监局)负责,主要由药品注册管理司(中药民族药监督管理司)组织实施,其职责包括组织拟订并监督实施国家药典等药品标准、技术指导原则,拟订并实施药品注册管理制度;监督实施药物非临床研究和临床试验质量管理规范、中药饮片炮制规范,实施中药品种保护制度;承担组织实施分类管理制度、检查研制现场、查处相关违法行为工作;参与制定国家基本药物目录,配合实施国家基本药物制度等工作。中国食品药品检定研究院承担药品检验检测工作;负责相关复验、技术仲裁;组织开展进口药品注册检验以及上市后有关数据收集分析等工作;承担药品质量标准、技术规范、技术要求、检验检测方法的制修订以及技术复核工作;组织开展有关国家标准物质的规划、计划、研究、制备、标定、分发和管理等工作。国家药典委员会负责组织编制、修订和编译《中国药典》及配套标准;组织制定修订国家药品标准;参与拟订有关药品标准管理制度和工作机制;组织《中国药典》收载品种的医学和药学遴选工作;负责药品通用名称命名等工作。国家药监局药品审评中心负责药物临床试验、药品上市许可申请的受理和技术审评;参与拟订药品注册管理相关法律法规和规范性文件,组织拟订药品审评规范和技术指导原则并组织实施;协调药品审评相关检查、检验等工作。国家药监局食品药品审核查验中心负责组织制定修订药品检查制度规范和技术文件;承担药物临床试验、非临床研究机构资格认定(认证)和研制现场检查;承担药品注册现场检查。国家药监局药品评价中心组织开展相关监测与安全性评价工作的技术标准、规范及质量管理规章制度的制修订并监督实施;组织开展相关监测与上市后安全性评价的方法研究、技术咨询和国际(地区)交流合作;指导地方相关监测与上市后安全性评价工作等。国家药监局行政事项受理服务和投诉举报中心负责药品行政事项的受理服务和审批结果相关文书的制作、送达工作;受理和转办药品涉嫌违法违规行为的投诉举报等。国家药监局信息中心承担国家药品安全监管信息平台建设,组织推进国家药品监管业务应用信息系统建设。国家药监局药品审评检查大湾区分中心主要负责协助国家药监局药品审评中心开展粤港澳大湾区区域内药品审评事前事中沟通指导及相关检查等工作;协助开展粤港澳大湾区区域内药品注册申请的受理、审评工作;协助开展粤港澳大湾区区域内药品注册申请相关核查,研制环节的有因检查工作;参与拟订药品注册管理相关法律法规和规范性文件;参与拟订相关药品技术审评规范、技术指导原则和检查制度规范、技术文件并组织实施等。
2.省级中药注册行政管理体系(以广东省为例)
广东省中药注册管理事项由广东省药品监督管理局(以下简称广东省药监局)负责,主要由行政许可处组织实施。其职责包括在国家药监局的指导下组织制定药品地方性标准及技术指导原则;监督实施药品标准、分类规则等管理制度,依职责组织实施药品行政许可,以及涉及的技术审查、审评检查、现场检查和抽样等工作。承担国家药监局委托的在港澳已上市传统外用中成药的注册审批。广东省药品检验所承担国家药监局授权的进口药品口岸检验、生物制品批签发和辖区药品的注册检验、监督检验及仲裁检验;参与制订、修订国家或省相关检验检测标准、技术规范;组织开展在港澳已上市传统外用中成药的注册检验等。广东省药监局审评认证中心负责广东省药监局委托的药品技术审评工作,药品研制、生产、经营、使用单位的许可事项及其变更的技术审查和现场检查的技术工作,以及药品广告的技术审查工作;承担在港澳已上市传统外用中成药的注册审评检查工作。广东省药监局事务中心承担广东省药监局行政许可事项的受理、发证工作;承担药品投诉举报等工作。
内地中药注册管理机构组织架构见图1,内地与香港、澳门中药注册管理机构对比见表1。
(二)香港中药注册行政管理体系
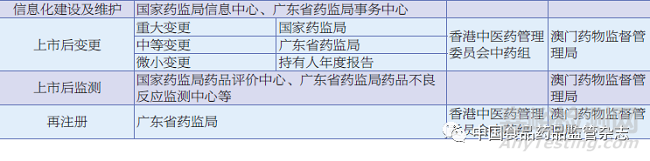
香港医务卫生局是香港医疗卫生系统的最高行政机构,其内设的中医药处负责在政策层面统筹和促进香港中医药发展。香港医务卫生局下设卫生署,其内设的中医药规管办公室为香港中医药行政管理的核心部门。此外,依据香港的《中医药条例》设立了香港中医药管理委员会,由卫生署署长或副署长任行政长官,由行政长官委任主席1名、公职人员2名、中医5名、中药业界人士5名、教育或科研机构人士2名、业外人士3名共同组成委员会,负责统筹和监管中医组和中药组的活动,包括决定须由各组实施的政策、审查有关各组活动的政策事宜、提供各组所要求的任何咨询及协助等。香港中医药管理委员会中药组下设中药管理小组,中药管理小组的中成药注册评审小组负责处理中成药注册申请的专业及技术性问题,提供专业意见。最终由中药组作出批准或拒绝中成药注册的申请、中成药更改注册详情的申请及作出取消中成药注册的决定。
香港中药注册管理机构组织架构见图2。
(三)澳门中药注册行政管理体系
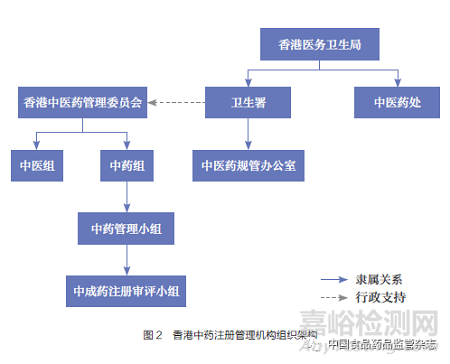
澳门药物监督管理局是澳门中药注册管理的行政机构,其内设注册厅下设的中药处负责编制中药及天然药物的质量、有效性及安全性评估报告;就中成药及天然药物的注册申请组成卷宗,并发出有关意见书,以及管理载于注册的资料;评估中药及天然药物的进口申请及进行分类;协助编制及建议与中成药及天然药物注册相关的技术性指示或指引;评估与中药及天然药物相关的广告许可的申请。依据《中药药事活动及中成药注册法》设立的中成药审评专家顾问委员会,承担澳门中成药注册审评工作。委员会由不少于11名的奇数专业人员组成,要求成员需具备相应专业技术职务并有10年及以上从业经验。委员会成员由澳门药物监督管理局局长建议,由澳门社会文化司司长批示委任,任期为3年。中成药注册涉及的研制场所检查和制造场所检查,均由澳门药物监督管理局组织实施。
澳门中药注册管理机构组织架构见图3。
二、中药注册法律法规体系及注册分类的对比
(一)内地中药注册法律体系及注册分类
内地中药注册法律法规分为国家和省两个层级,国家层级的法律法规文件构建了全国中药注册管理的纲领和主要管理准则,各省份按照各自产业发展实际和监管需求,在国家法律法规的框架下制定地方性法规和地方部门规章等作为有机补充。在国家层面,药品注册管理以《药品管理法》《中医药法》等法律为总纲,以《药品管理法实施条例》为具体要求,以《药品注册管理办法》《中药注册管理专门规定》[3]等部门规章及其配套技术指导原则进一步细化药品注册各环节的工作程序和技术要求。在省级层面(以广东省为例),广东省颁布《广东省中医药条例》《广东省岭南中药材保护条例》等地方性法规,以及《广东省医疗机构制剂注册与备案实施细则》[4]等地方部门规章,共同为广东省的中药全生命周期注册管理工作提供完善的法律体系保障。
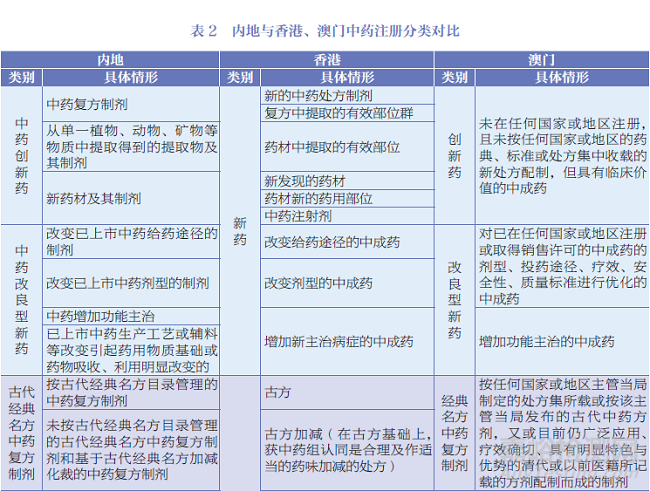
内地的中药注册对象包括中成药、部分中药材(中药饮片)和天然药物,按照《中药注册分类及申报资料要求》[5]分为六大注册类别,由国家药监局实施批准文号管理,颁发药品注册证书,有效期为5年。境内生产的药品,药品上市许可持有人需在有效期届满前6个月向所在地省级药品监管部门提交再注册申请;境外(含香港、澳门、台湾地区)生产的药品,需向国家药监局药品审评中心提出再注册申请;其中在港澳已上市传统外用中成药的再注册管理,由国家药监局委托广东省药监局实施。药品上市后,药品上市许可持有人可主动向国家药监局申请注销文号,或由国家药监局对存在重大质量风险或安全风险的药品作出注销或撤销文号的行政决定。
医疗机构配制的中药制剂的注册事项由所在地省级药品监管部门实施管理,按照是否采用传统工艺配制分别实施注册和备案两种方式的管理。
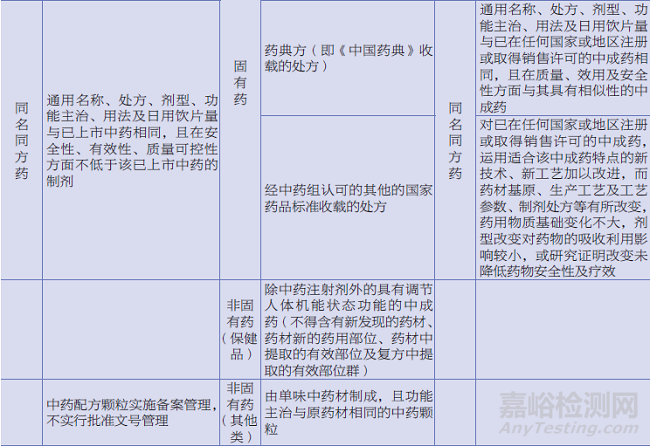
内地与香港、澳门中药注册分类对比见表2。
(二)香港中药注册法律体系及注册制度
香港的中药注册活动以《中医药条例》为纲领,按照《中医药条例》设立中药规管制度,实施中药商发牌制度和中成药注册制度,通过《中药规例》《中医药(费用)规例》及相关技术指引文件规定中成药注册制度的相关工作程序及技术要求。
香港的中药注册对象为中药材、中药制剂、中药保健品和中药配方颗粒,分为3种注册类别。获得批准注册的中成药将获发中成药注册证明书,有效期为5年,在证明书有效期届满前1年,中成药注册持有人将收到香港中医药管理委员会中药组寄出的《中成药注册证明书续期通知书》《中成药注册续期申请书》及《中成药注册续期补交文件清单》,中成药注册持有人需于《中成药注册证明书续期通知书》发出之日起计6个月内按要求向中药组提交续期申请。
此外,针对香港中成药的历史情况,对1999年3月1日前已在香港生产或流通的中成药,可在2003年12月19日至2004年6月30日期间申请过渡性注册,经中药组确认符合过渡性注册资格的视同获批注册,发放《确认中成药过渡性注册通知书》,由《确认中成药过渡性注册通知书》持有人在规定期限内提交正式注册申请,经中药组审核符合注册要求的,发放中成药注册证明书;经中药组确认不符合过渡性注册资格的中成药,需重新提交正式注册申请。
(三)澳门中药注册法律体系及注册制度
澳门的中药注册活动需按照《中药药事活动及中成药注册法》开展,具体行为遵照《中药药事活动及中成药注册法实施细则》等行政法规及《批准药品入口前必须呈交之文件》[6]等技术指引执行。
澳门的中药注册对象仅指不含化学药成分的中药制剂,分为4种注册类别。天然药物需配合相关法规文件和技术指引,参照《中药药事活动及中成药注册法》执行。获得批准注册的中成药将获发中成药注册证明书,有效期为5年,注册持有人需在中成药注册证明书有效期届满前至少90日向澳门药物监督管理局提出续期申请;其中改良型新药及创新药的首次注册续期,注册持有人须向澳门药物监督管理局提交证明有关中成药于注册有效期内通过成效及稳定性试验的报告。
三、粤港澳三地中药产业协同发展的思考
粤港澳大湾区与美国的纽约湾区、旧金山湾区和日本的东京湾区相比,在区域面积和人口数量方面有着显著优势,有着一个国家、两种制度、三个关税区的独特格局。但是,粤港澳三地法律体系上的差异,是粤港澳大湾区资源整合的巨大难题。如何发挥粤港澳三地各自优势,形成互补协同,是粤港澳大湾区建设的重中之重。
自《粤港澳大湾区发展规划纲要》发布以来,粤港澳大湾区建设火热,捷报频传。随着《全面深化前海深港现代服务业合作区改革开放方案》[7]《横琴粤澳深度合作区建设总体方案》[8]《广州南沙深化面向世界的粤港澳全面合作总体方案》[9]的先后发布,粤港澳大湾区规则衔接进一步深化,“软联通”不断突破,生产要素流通更加自由。中成药在粤港澳大湾区内部流通方面,按照《粤港澳大湾区药品医疗器械监管创新发展工作方案》,国家药监局委托广东省药监局对在港澳已上市传统外用中成药实施简化审评,截至2023年3月,广东省药监局已发出10张港澳传统外用中成药的内地药品注册证书,推动92万瓶港澳传统外用中成药进入粤港澳大湾区内地市场;按照《中药药事活动及中成药注册法》,化湿败毒颗粒、复方板蓝根颗粒等中成药先后在澳门注册上市,进一步满足澳门居民的用药需求,促进澳门经济适度多元发展。在中药国际化方面,以澳门为内地与葡语系国家之间的桥梁,推动巴西将《中国药典》收载的且不含毒性成分、重金属成分和动物药成分的中药,纳入中医药产品分类管理,符合条件的中成药完成备案后即可在巴西的医疗机构、药房内销售;推动莫桑比克将符合上述要求,或取得中国药品批准文号的中药纳入植物药分类进行注册管理。在国家中医药服务出口基地(粤澳合作中医药科技产业园)的协助下,截至2022年底,已有9款中成药产品进入巴西市场,10款中成药产品在莫桑比克完成注册[10]。
粤港澳大湾区自古就是岭南地区的核心区域,粤港澳三地文化同根同源,且均具有深厚的中医药文化底蕴和群众基础。为充分发挥粤港澳三地中医药互补优势,推动粤港澳三地中药合作向纵深发展,进一步推动中药的国际化、现代化和规模化进程,提出以下几点建议。
一是发挥内地制造业优势,为港澳中药赋能。广东省是改革开放的前沿阵地,截至2022年底,区域内中成药制剂生产企业167家,中药饮片生产企业197家,13家企业上榜中国中药企业百强,居全国首位;规模以上中药生产企业超过170家,中药制造业产业基础雄厚。按照国家药监局印发的《支持港澳药品上市许可持有人在大湾区内地9市生产药品实施方案》[11],港澳药品可在不变更药品上市许可持有人的情况下,将持有的药品委托粤港澳大湾区内地企业生产。这一政策可帮助港澳企业在保持主体不变的情况下有效解决生产用地不足、生产产能与市场需求不相匹配的困局,充分发挥粤港澳大湾区内地创新转化及产品制造的优势,进一步加速推动粤港澳大湾区生物医药产业深度融合,实现粤港澳大湾区医药产业共同发展。
二是进一步发挥港澳地区优势,助力内地中药走向国际。充分发挥港澳“背靠祖国,联通世界”的优势,将中医药产业发展作为港澳服务“一带一路”倡议的重要内容,充当内地中医药产品走向海外的“桥头堡”。一方面,运用“以医带药”模式,加强中药的国际推广。通过澳门在葡语系国家开展医疗服务,提供医疗援助,以切实的临床疗效增强内地中药产品在国际上的认可度。另一方面,充分发挥香港国际自由贸易港在关税壁垒、通关手续等方面的优势,助力内地中药产品以更便捷的形式“走出去”。此外,可通过加强粤港澳三地中药政策与技术的合作研究,推动三地中药注册机制的衔接,建立粤港澳大湾区互通互认的中药标准。借助港澳参加国际学术活动的便利性,推广中药全产业链质量控制理念,提升我国在中药国际质量标准中的话语权。
三是发挥粤港澳大湾区中药综合优势,探索中药审评审批制度改革。近年来,广东先后发布了多个支持中医药产业发展的地方性法规,在政策上予以大力支持。在粤港澳大湾区探索开展中药审评审批制度改革具有良好的政策基础、产业基础和群众基础。建议在粤港澳大湾区建设中药创新研发中心,加强政策和资金的扶持,吸引全球中药研发先进技术、高端人才向粤港澳大湾区聚集。充分发挥国家药监局药品审评检查大湾区分中心对广东省中药新药研发的靠前指导作用,完善中药新药研审联动工作机制,并谋划在粤港澳大湾区成立中药注册技术审评专门机构,引导研发机构按照中医药理论思维开展中药新药的研究。鼓励粤港澳大湾区率先对国医大师、名老中医等具有丰富中医临床经验的经验方进行挖掘和应用,支持安全性好、疗效确切的医疗机构制剂进行二次开发,探索广东省的医疗机构中药制剂在香港、澳门上市注册的简化程序,进一步积累人用经验数据并用于内地新药注册上市的“大湾区路径”。