您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-03-01 11:06
本文适用于与正畸丝等配套,供牙齿正畸治疗用的正畸托槽。
目前临床用于牙齿正畸治疗的器械分二类:一类是由患者自行佩戴和拆卸的活动矫治器,另一类是由专业正畸医生通过临床安装的固定矫治器。管理类别为Ⅱ类,分类编码为17-07-01。
一、正畸托槽的结构组成与器械及操作原理
1.产品的结构及组成
正畸托槽,通常可由正畸槽沟(又称弓丝槽)、结扎翼、粘接用底板、牵引钩(仅限带钩的正畸托槽)、活动锁片/锁盖/锁夹(仅限自锁式正畸托槽结构)和粘接剂(仅限于粘接剂预置托槽)组成。
2.器械及操作原理描述
2.1正畸托槽产品的外形结构图列举如下,产品技术要求中的示意图建议采用产品工程图:
2.1.1方丝弓正畸托槽

图1 方丝弓正畸托槽示意图
2.1.2舌侧正畸托槽

图2 舌侧正畸托槽示意图
2.1.3直丝弓正畸托槽

图3 直丝弓正畸托槽示意图
2.1.4陶瓷正畸托槽

图4 陶瓷正畸托槽示意图
2.1.5自锁式正畸托槽

图5 自锁式正畸托槽示意图
2.2正畸托槽的结构说明:
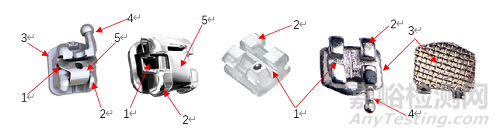
1、槽沟 2、结扎翼 3、粘接用网底 4、牵引钩 5、活动锁盖
图6 正畸托槽结构示意图
2.3产品材料
正畸托槽可采用不锈钢、镍钛合金、陶瓷等满足生物安全性能要求的医疗器械适用材料。
2.4产品工作原理
正畸托槽通常设计成有正畸槽沟、结扎翼和粘接底板结构形状,在正畸托槽粘接底板表面涂上粘接剂后,粘贴在经过预处理的牙面指定位置。若有必要,可用不锈钢结扎丝或者橡皮结扎圈,通过结扎翼把正畸丝固定在正畸托槽的正畸槽沟内,持续将正畸丝释放的回复力传递给牙齿,从而实现控制牙齿的移动,达到牙齿畸形矫正的作用。企业还应根据自身产品的特性,增加作用机理的描述。
二、正畸托槽的主要风险
根据《医疗器械风险管理对医疗器械的应用》附录D用于医疗器械的风险概念YY/T 0316对该产品已知或可预见的风险进行判定,开发人还应根据自身产品特点确定其他危害。
主要危害例举如下:
表1 产品主要危害
|
危害的分类 |
危害的形成因素 |
可能的后果 |
|
|
生物学危害 |
生物不相容性。 |
用于生产加工正畸托槽的材料,不具有良好的生物相容性。 |
使用中产生细胞毒性、致敏反应等。 |
|
材料过敏。 |
使用前未了解患者过敏史。 使用说明书中未警示。 |
引起材料过敏。 |
|
|
机械力 |
锐边、毛刺。 |
与人体口腔内口腔黏膜和软组织接触的部分,存在过大的锐边、毛刺等。 |
对患者口腔黏膜及软组织造成意外伤害。 |
|
环境 危害 |
储存或运行偏离预定的环境 条件。 |
储运条件(如温度、湿度、酸碱度)不符合要求。 |
产品变色、锈蚀。 |
|
意外的机械 破坏。 |
储运、使用过程中发生意外的机械性破坏。 |
产品使用性能无法得到保证或者无法保证正常使用。 |
|
|
与医疗器械使用有关的危害 |
不适当的标记。 |
标记不清晰、错误,没有按照要求进行标记。 |
错误使用。 储存错误。 产品辨别错误。 |
|
不适当的操作 说明,如: (1) 和正畸托槽配合使用的正畸颊面管、正畸丝选择不适当。 (2) 使用说明书未标注正畸托槽的转矩角、轴倾角和补偿角等 关键数据。 |
没有注明正畸托槽所属技术系统。 正畸托槽参数标注 错误。 |
无法保证使用的有效性。
|
|
|
由非专业的人员使用。 |
不熟悉正畸托槽所属技术系统的操作流程。 规格型号选用错误。 未使用到指定牙位。 |
导致无法正常使用。 或造成牙槽骨损伤。 |
|
三、正畸托槽性能研究实验要求
正畸托槽常见的通用技术指标包括但不限于以下内容:外观;尺寸;正畸托槽厚度、槽沟(孔)深度、槽沟(孔)宽度、槽沟(孔)长度、每个辅工槽(孔)的尺寸、转矩角、轴倾角、补偿角;金属表面粗糙度;耐腐蚀性。
1、产品性能研究
在开展产品性能研究时,应至少对产品的代表性样件进行功能性、安全性指标研究。此外,还应明确与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
如适用,产品研究应包含为保证正畸托槽的安全有效而设定的相关特性,如:带活动锁盖的自锁式正畸托槽,其锁盖、锁片、锁夹等的可靠性和疲劳性能(如脱落、变形)等内容。
2、生物相容性评价研究
应参照GB/T 16886系列标准《医疗器械生物学评价》、YY/T 0268《牙科学口腔医疗器械生物学评价第1单元:评价与试验》等适用标准对成品中与患者或者使用者直接或间接接触的材料的生物安全性进行评价。评价应包括:生物相容性评价的依据和方法、所用材料及与人体接触的性质、实施或豁免生物学试验的理由和论证、对于现有数据或试验结果的评价。评价的试验项目应包括:细胞毒性、迟发型超敏反应、刺激或皮内反应、亚慢性(亚急性)全身毒性、遗传毒性。
3、灭菌/消毒工艺研究
正畸托槽一般采用非无菌交付,由终端用户灭菌/消毒。
应向医疗机构提供经过确认的灭菌/消毒方式,若该灭菌/消毒方式为行业内通用,那么应开展灭菌/消毒过程对产品性能影响的相关验证;若该灭菌/消毒方式行业内不通用,那么除开展过程对产品性能影响的相关验证外,还应当对灭菌/消毒效果进行确认。
4、产品有效期和包装研究
正畸托槽为无源器械,非重复使用产品。
产品的包装应能保证在宣称的有效期内以及运输储运条件下,保持完整。
5、其他研究
证明产品安全性、有效期的其他研究。

来源:嘉峪检测网


