流行病等细菌感染相关疾病是对公共卫生的主要威胁,已成为全球的十大死亡原因之一。因此,迫切需要新的、高效的策略来对抗细菌感染,并有大量的努力致力于开发替代抗菌剂。抗菌剂的杀菌效果如何,需要通过一系列体外抗菌实验来验证。那么表征抗菌剂抗菌效果的方法有哪些,你知道吗?
一、平板计数法
1.评价标准
抗菌剂对细菌进行杀菌处理以后,将细菌稀释到合适的倍数进行平板涂布并对长出的菌落进行计数。通过计算细菌存活率或者致死率来表征抗菌剂抗菌效果。
计算公式如下:
2.应用:ZnO/C介导的k-卡拉胶伪巴氏杀菌膜用于金柑保鲜[1]
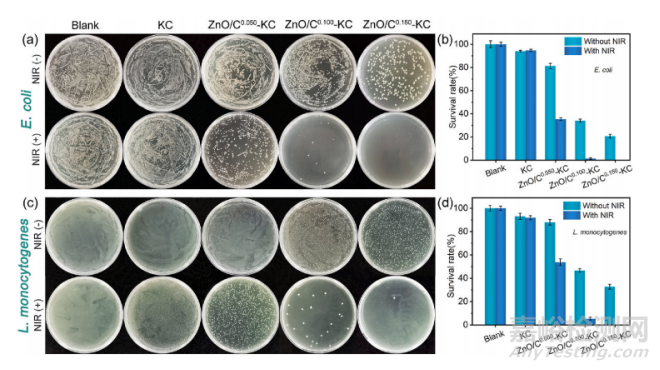
为了对抗食源性微生物引起的金橘腐病,西北农林大学王建龙教授团队开创了伪巴氏杀菌的概念,并将其与包装技术相结合开发了一种用于储存和保存金橘的新型抗菌包装膜。首先构建了具有优异光热性能的锌掺杂碳纳米颗粒(ZnO/C),然后将其加入k-卡拉胶(KC)基质作为填充物中,得到一系列ZnO/C-KC纳米复合薄膜。ZnO/ C-KC薄膜由于近红外诱导的光热效果与ZnO组分之间的协同杀菌作用而表现出优异的抗菌性能(抗菌率≥99.8%),其中薄膜杀菌的平衡温度(60–62 ℃)和保温时间(5 min)显著低于传统巴氏杀菌。
通过平板涂布实验,以大肠杆菌(E. coli)和单核增生李斯特菌(L. monocytogenes)分别作为革兰氏阴性菌和革兰氏阳性菌的典型模型,评价了ZnO/C-KC膜的伪巴氏杀菌活性。与对照组相比,单独的KC膜处理使E. coli和L. monocytogenes的存活率略有下降(下降约7%),而NIR辐射对KC膜的抗菌活性没有显著影响。对于ZnO/C-KC纳米复合薄膜,在没有NIR辐射的情况下,观察到剂量依赖的杀菌效果。由于ZnO的存在,E. coli的存活率从94.0%下降到21.7%,L. monocytogenes的存活率从93.1%下降到36.8%。当ZnO/C-KC薄膜暴露于NIR辐射后,由于触发的光热治疗(PTT)与ZnO固有的抗菌特性之间的协同作用,它们对两种菌株均表现出显著增强的抗菌活性。
二、活死染色法
1.评价标准
对细菌进行活死染色也是一种常用的表征抗菌效果的方法。抗菌剂对细菌进行处理后,再对细菌进行活死染色。目前有许多品牌的细菌活死染色试剂盒,以SYTO-9和PI为例,SYTO-9是一种能够透过细胞膜的绿色荧光核酸染料,可用于活的和死的真核细胞的RNA和DNA染色,以及革兰氏阳性和革兰氏阴性细菌。PI是一种可对DNA染色的细胞核染色剂,在嵌入双链DNA后释放红色荧光。PI不能穿透完整细胞膜,但对凋亡晚期细胞和死细胞的破损细胞膜能够穿透,并使细胞核红染。
染色结果如下:
|
细菌状态 |
SYTO-9(绿) |
PI(红) |
染色效果 |
|
活且无凋亡和细胞膜损伤 |
+ |
- |
绿色 |
|
活但出现凋亡和细胞膜损伤 |
+ |
+ |
黄绿色(红绿重叠) |
|
死(凋亡和细胞膜损伤) |
- |
+ |
红色 |
+:阳性结果;-:阴性结果
2.应用:氧空位介导的α-MoO3杀菌纳米催化剂[2]
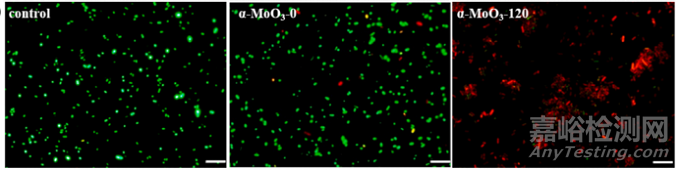
在表面分子水平上了解纳米材料的细菌失活机制,对于开发抗菌材料及其在抑制病原微生物传播中的应用具有重要意义。中国科学院气溶胶化学与物理重点实验室黄宇研究员团队制备了一种氧空位介导的杀菌纳米催化剂α-MoO3,该催化剂在黑暗中对大肠杆菌和金黄色葡萄球菌具有良好的抑菌活性。通过操纵α-MoO3的表面结构,可以轻松地实现超氧自由基(∙O2-)的生成。∙O2-通过攻击脂多糖(LPS)和磷脂酰乙醇胺(PE)来破坏细菌的细胞膜。
采用红色荧光碘化丙啶(PI)核酸染色和绿色荧光核酸染料(SYTO-9)进行荧光细胞活/死试验,验证所制备的抗菌剂的抗菌性能。未处理的细菌显示出密集的绿色荧光。经α-MoO3-0处理后,只能观察到少量的红色荧光菌。经α-MoO3-120处理后,几乎所有细胞均染成红色,提示细菌细胞膜受损,细菌死亡。
三、扫描电镜表征法
1.评价标准
抗菌剂对细菌进行处理后,可能会引起细菌形态的变化,如褶皱凹陷或者破损。因此通过拍摄扫描电镜观察细菌形态也是表征抗菌剂抗菌效果的手段之一。
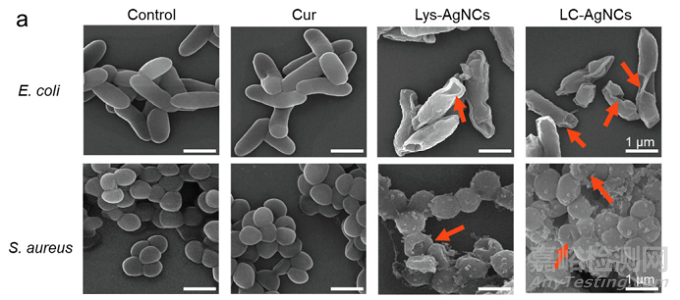
2.应用:具有高度生物相容性的银纳米团簇增强伤口敷料[3]
西北工业大学尚利教授团队开发了一种具有增强协同抗菌能力的高生物相容性银纳米团簇增强水凝胶。将具有生物活性的姜黄素引入到溶菌酶保护的超小银纳米簇中,并通过多重相互作用力进一步与海藻酸钠(Sa)水凝胶整合。LC-AgNCs的杀菌作用在于其破坏细菌膜、产生活性氧(ROS)、耗尽谷胱甘肽和破坏促氧化-抗氧化系统的能力。姜黄素可以调节细胞内ROS平衡,保护NIH 3T3细胞免受氧化应激,改善LC-AgNCs@Sa的生物相容性。具有长期抗菌能力的LC-AgNCs@Sa由于其抑制炎症因子(TNF-a)产生、促进胶原沉积和促进再上皮化的独特功能,可有效保护伤口免受体内细菌入侵,并显著加速伤口愈合过程。这项研究为设计用于广泛感染性疾病治疗的高性能抗菌敷料提供了一种新的通用的策略。
如图所示,LC-AgNCs处理前的E. coli呈清晰的杆状,表面光滑,结构完整。经LC-AgNCs处理后,细菌表面起皱,附近许多细菌的膜融合,表明细菌严重塌陷。对S. aureus也观察到类似的结果,这意味着LC-AgNCs的处理可以显著破坏细菌膜的完整性。
四、清除生物膜
1.评价标准
近年来,随着医学界对某些环境中常见细菌所致的一些慢性和顽固性疾病的深入了解,发现生物膜(生物被膜)是导致这些细菌性疾病难以根治的主要原因。以生物膜形式存在的细菌对抗生素等杀菌剂、恶劣环境及宿主免疫防御机制有很强的抗性,因此评价抗菌剂对生物膜的抑制效果也是评价抗菌剂杀菌效果的标准之一。通过结晶紫染色观察生物膜剩余面积或者测其OD值可以表征抗菌剂对生物膜的抑制效果。另外也可以用过荧光共聚焦成像来表征对生物膜的抑制效果。
2.应用:介孔二氧化硅纳米复合材料具有尖峰纳米拓扑结构和增强的生物膜抑制性能[4]
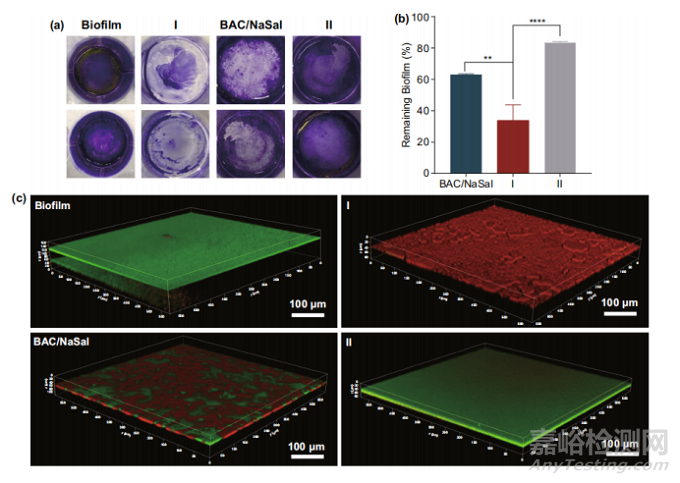
澳大利亚昆士兰大学余承忠教授团队报道了一种“双活性模板”策略用于二氧化硅复合材料的设计。该策略使用阳离子和阴离子结构导向剂作为双模板,两者都具有活性抗菌性能。阳离子-阴离子双活性模板策略有助于开发具有尖刺表面的抗菌纳米复合材料。通过双活性抗菌剂的可控释放,该纳米复合材料对表皮葡萄球菌显示出增强的抗菌和抗生物膜特性。
通过检查纳米复合材料抑制细菌表面粘附和生物膜形成的效率,进一步评估了纳米复合材料的生物膜抑制性能。将纳米复合物或BAC/NaSal添加到浮游细菌中,用结晶紫染色来观察不同处理组的剩余生物膜,如图所示,对照组和纳米复合材料II组显示深紫色,表明更多的生物膜形成,BAC/NaSal或纳米复合材料I处理组表现出明显较浅的颜色,表明其具有抑制生物膜形成的能力。归一化结果显示,纳米复合材料I的抑制效果显著(33%)优于纳米复合材料II(85%)和BAC/NaSal(63%)。为了更好地分析生物膜的厚度,采用三维共聚焦显微镜对LIVE/DEAD细菌进行染色和分析。未经处理的生物膜的厚度估计为25 μm。在纳米复合材料I孵育24小时后,观察到更薄的生物膜(<10 μm),死亡细胞数量显著增加(>90%)。而在BAC/NaSal(约15 μm)或纳米复合II(22 μm)处理组上形成较厚的生物膜。以上结果表明,“双活性模板”纳米复合材料I在抑制生物膜形成方面表现出良好的协同作用。
参考文献
1.Zhang L, Wang W, Ni Y, et al. ZnO/C-mediated k-carrageenan based pseudo-pasteurization films for kumquat preservation[J]. Food Hydrocolloids, 2022, 128: 107582.
2.Gao Q, Wang Z, Rao Y, et al. Oxygen vacancy mediated α-MoO3 bactericidal nanocatalyst in the dark: Surface structure dependent superoxide generation and antibacterial mechanisms[J]. Journal of Hazardous Materials, 2023, 443: 130275.
3.Wang T, Li Y, Liu Y, et al. Highly biocompatible Ag nanocluster-reinforced wound dressing with long-term and synergistic bactericidal activity[J]. Journal of Colloid and Interface Science, 2022.
4.Song Y, Sun Q, Luo J, et al. Cationic and Anionic Antimicrobial Agents Co-Templated Mesostructured Silica Nanocomposites with a Spiky Nanotopology and Enhanced Biofilm Inhibition Performance[J]. Nano-micro letters, 2022, 14(1): 1-11.