您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-12-20 14:17
本文适用于《医疗器械分类目录》中14-10-01创面敷贴类和14-10-02按第二类医疗器械管理的创口贴类产品,以无菌形式提供。
一、非慢性创面敷贴结构组成与作用机理
1.结构组成
非慢性创面敷贴通常由涂胶基材、吸收垫、离型层组成,部分产品可具有防粘连层,其基本结构如图1、图2所示。其中吸收垫一般采用可吸收渗出液的材料制成,所含成分不具有药理学作用,不可被人体吸收。吸收垫(创口贴敷垫除外)可单独使用,用绷带或胶带等进行固定。无菌提供,一次性使用。
1.1涂胶基材
通常由涂有医用压敏胶、丙烯酸粘胶等的薄膜或无纺布制成,薄膜材质可为PU、PP、PVC、PE、EVA等,用于固定敷垫,粘敷皮肤表面。
1.2吸收垫
通常由棉纤维、无纺布等可吸收渗出液的材料制成,不含药物成分或生物活性成分,固定在涂胶基材上,用于吸收渗出液。
1.3防粘连层
通常由一层防粘材料(如PE网膜、打孔膜等)制成,覆盖在敷垫的创面接触表面上,用于防止敷垫与创面粘连。
1.4离型层
通常由格拉辛纸、PE膜或聚对苯二甲酸乙二醇酯(PET)膜等制成,覆盖在涂胶基材上,使用前揭除,用于保护敷贴不受破坏。
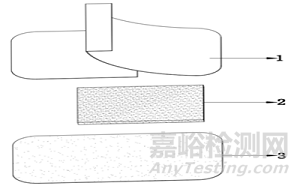
1-离型层 2-吸收垫3-涂胶基材
图1 典型非慢性创面敷贴结构示意图
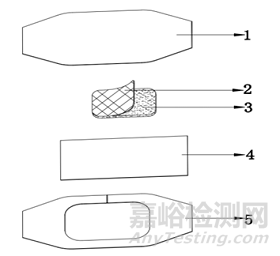
1、5-离型层 2-防粘连层3-吸收垫4-涂胶基材
图2 带防粘连层的非慢性创面敷贴结构示意图
2. 作用机理
通过薄膜或无纺布等将创面与外部环境隔离,保护创面避免受到外部环境的污染;或通过吸收垫吸收创面渗出液,避免创面被渗出液浸渍,为非慢性创面愈合提供微环境。其固定、吸收渗液的机理如下:
2.1固定:通常由聚氨酯(PU)、聚丙烯(PP)、聚氯乙烯(PVC)、聚乙烯(PE)、乙烯-醋酸乙烯共聚物(EVA)等薄膜或无纺布涂敷医用压敏胶、丙烯酸粘胶等,通过胶的压力敏感粘附作用粘贴到皮肤表面,或通过其他物理方式(如绷带、魔术贴)将吸收垫固定于皮肤表面。
2.2吸收:通过吸收垫纤维的亲水性和纤维表面及内部贯通的毛细微孔吸收保存渗液。
二.非慢性创面敷贴性能研究实验要求
1.产品性能研究
产品性能研究应包括有效性、安全性指标以及与质量控制相关的其他指标。建议参考行业标准YY/T 1627《急性创面用敷贴、创贴通用要求》,根据产品的性能特点,制定适合产品的技术指标。
2.联合使用
结合产品的特点,证明产品安全性、有效性的其他研究。。
3.生物学特性研究
参照《医疗器械生物学评价和审查指南》、GB/T 16886.1的要求对其进行生物相容性评价。
3.1生物学试验至少包括细胞毒性、刺激或皮内反应、皮肤致敏反应的生物学评价研究。
3.2若开展产品与已上市产品等同性比较的生物相容性评价,应按照《医疗器械生物学评价和审查指南》要求进行评价,证明产品与已上市产品具有等同性。
若无法证明产品与已上市产品的等同性,可按照GB/T 16886.1的要求开展申报产品生物相容性试验予以评价。
4.灭菌工艺研究
参照GB 18279.1、GB 18280系列和GB/T 16886.7等标准的要求,选择产品包装及灭菌方法,并开展以下方面的确认:
4.1产品与灭菌过程的适应性:应考察灭菌方式、灭菌工艺过程对于非慢性创面敷贴的影响。
4.2包装与灭菌过程的适应性。
4.3应明确灭菌工艺(方法和参数)和无菌保证水平(SAL)。无菌保证水平(SAL)应达到1×10-6。
4.4残留毒性:若灭菌使用的方法容易出现残留,如环氧乙烷灭菌,应当明确残留物信息及采取的处理方法。
5.稳定性研究
5.1货架有效期
根据YY/T 0316标准附录E的举例,对产品的可能危害进行判定。表1为非慢性创面敷贴常见危害示例:
表1 产品主要危险(源)
|
危险(源) |
可预见的事件序列 |
危险情况 |
可能发生的伤害 |
采取的措施 |
|---|---|---|---|---|
|
生物学相容性 |
(1)原材料生物相容性差。 (2)加工工艺控制不严格。 |
采用了不合格原辅材料; 生产引入了外来物质、工艺物质没有被有效去除; 灭菌剂残留于高吸附的敷贴中。 |
毒性或刺激。 |
产品设计开发过程筛选合格原材料,原材料入厂检验; 严格控制生产过程; 企业选择经过确认的灭菌工艺进行灭菌; |
|
生物学危害(微生物污染) |
(1)生产环境控制不达标。 (2)灭菌操作不规范。 (3)包装材料选择不适当。 (4)包装封口缺陷。 |
灭菌不彻底。 |
引起患者感染。 |
严格控制生产环境及包装工艺。 企业选择经过确认的灭菌工艺进行灭菌; 产品出厂前进行抽样检验,性能要求合格后方可出厂。 |
|
化学危害 |
(1)原材料控制不严格。 (2)灭菌操作对环氧乙烷残留量的控制不达标。 |
(1)化学性能不符合要求。 (2)环氧乙烷及其衍生物输入人体。 |
损害使用人员及患者健康。 |
产品设计开发过程筛选合格原材料,原材料入厂检验; 采用经过确认的方式进行解析,环氧乙烷残留量达标后方可出厂。 |
|
运输和储存(不适当的环境条件) |
储存或运输条件偏离预定的环境条件(如温度、湿度)。 |
(1)产品非正常老化。 (2)产品使用有效期缩短,产品带菌。 |
功能性、使用性丧失。 引起患者感染。 |
规范说明书。 |
|
储运、使用过程中发生意外的机械性破坏。 |
(1)产品带菌。 (2)产品使用性能无法得到保证。 |
引起患者感染。 功能性、使用性丧失。 |
规范说明书。 |
|
|
废弃物处理 |
产品使用后,未经医疗垃圾处理。 |
有害物质影响环境。 |
环境污染。 交叉感染。 |
规范说明书。 |
|
标记 |
(1)标记不清晰、错误。 (2)没有按照要求进行标记。 |
(1)错误使用。 (2)储存错误。 (3)产品辨别错误。 (4)导致无法保证使用安全性。 |
引起患者感染。 操作失效。 |
标记印刷清晰正确; 标记内容按相关要求标记全面。 |
|
操作危害 |
产品的使用人员未接受培训,使用产品时操作不当。 |
患者接触了有菌的产品。对一次性使用产品的很可能再次使用的危害性警告不适当。 |
交叉感染。 |
说明书上提示。 |
|
信息危害 |
不当的说明书。 说明书上的注意事项不全。 |
使用了不适当的产品。 产品使用处置不当。 产品超期使用 |
功能性、使用性丧失。 人员感染。 破坏环境。 |
规范说明书。 |
|
警告 |
对一次性使用医疗器械很可能再次使用的危害警告不适当。 |
重复使用。 |
交叉感染。 |
规范说明书。 |

来源:嘉峪检测网


