您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-27 13:46
摘要:分析方法验证中可接受标准的制定是一个值得深入讨论的话题,本文结合实际工作体会对1、破坏实验中峰纯度问题2、溶液稳定性考察中可接受标准问题表达下自己的观点,不足和缺陷之处,望批评指正。
一、破坏实验中关于峰纯度的问题
我们在进行破坏实验时,有时会遇到峰纯度不通过的情况,排除杂质包裹还存在以下两个原因,在实际工作中可以采取以下两种方式分别处理
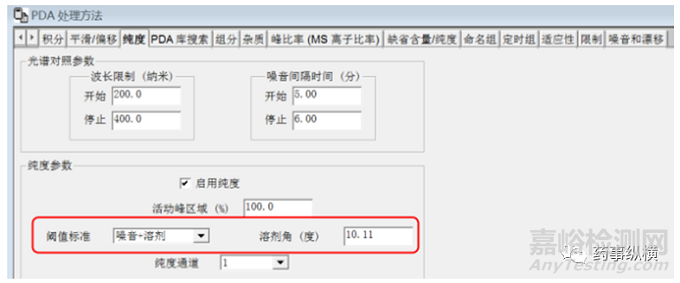
1、溶剂的问题,导致峰纯度不通过。在进行峰纯度统计时,需计算溶剂角,并且阈值算法改为“噪音+溶剂”;“溶剂角”以最高浓度的样品为供试品,连续进6针(这6针样品的最大值图中的色谱峰峰高应不小于1.0AU)。
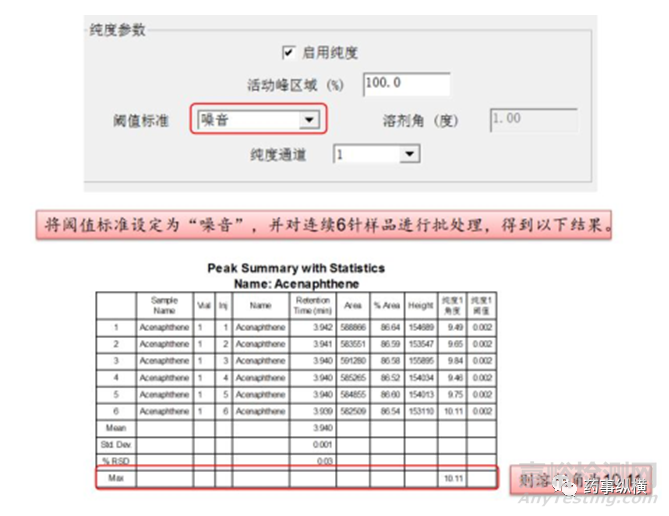
将上述10.11参照下图输入至相应位置
2、主峰过载问题导致峰纯度不通过,可适当降低主成分浓度(满载不超载)后在进行峰纯度统计。
二、溶液稳定性考察是统计相对标准偏差还是变化率
2.1、各国法规指南相关要求
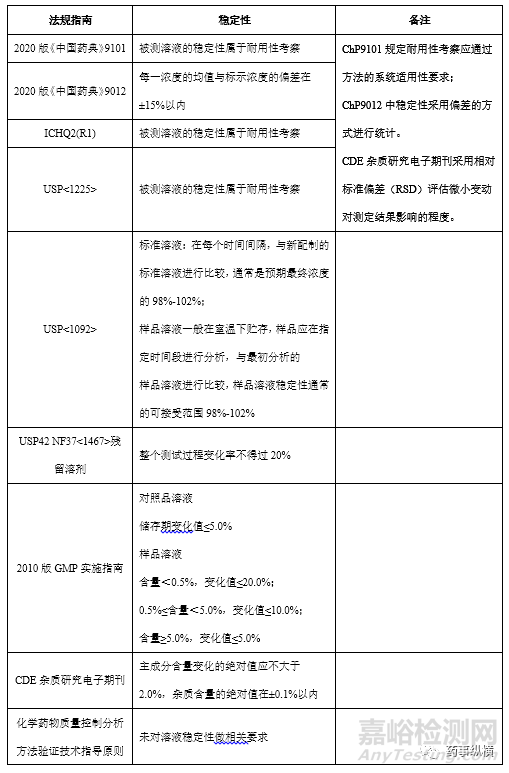
相对标准偏差(RSD):又称为变异系数,是反映一组测量数据离散程度的统计指标,其计算公式为RSD%=标准偏差/测定平均值*100%;变化率:变化率%=∣测定值-初始值∣/初始值*100%。变化率,参照USP<1092>,样品溶液稳定性通常可接受范围为98%-102%,以变化率表示为2%;RSD,参照2020版《中国药典》9012,样品溶液的稳定性可以用偏差表示。采用变化率可以更敏感的评估样品稳定性的变化情况,但0h值应测定准确,否则所有统计结果均会偏离。采用RSD%可以评估整个样本量的离散程度,但无法明显看出不同点的变化趋势。个人认为采用上述任何一种统计方式均可,可接受标准应基于2020版《中国药典》9101指导原则及方法的自身特定制定合理的可接受标准即可。变化率的计算公式类似于回收率,根据2010版GMP指南准确度项下相关规定,若某杂质变化率为10%(范围90%-110%),则RSD应控制在5%左右,应用举例如下:2.2、个人看法及应用举例
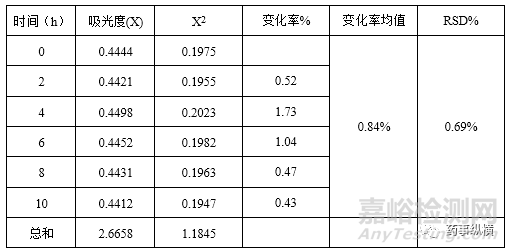

根据公式1和公式2吸光度变化率的极大值为1.73,极小值为0.43,均值0.84%,吸光度RSD为0.69%可知,若变化率为2%(98%-102%),则相对标准偏差(RSD)应控制在1%以内。
三、关于分析方法验证是否加杂质的思考
3.1、含量分析方法验证专属性是否需要加杂质
根据ICHQ2(R1) 对于含量分析,需要证明在杂质和辅料存在的情况下区别出被测物;实际操作中,可以将一定量的杂质和/或辅料加入到纯物质(原料药或制剂)中,证明含量分析结果在这些物质的存在下不受影响(通过比较不含加入物质的样品)。同时采用破坏实验对潜在的潜在的降解杂质的干扰进行评估。
3.2、有关物质分析方法验证中精密度是否需要加杂质
有关物质即有机杂质,包括工艺中引入的杂质和降解产物等,该类杂质的化学结构一般与活性成分类似或具渊源关系。根据ICHQ2(R1)分析方法验证精密度项下相关要求“精密度应该用同一均匀,权威样品进行考察。然而,如果不能获得同一均匀样品,可以用人工制备样品或样品溶液进行考察。”
根据FDA分析方法验证指南,用于放行检测的分析方法应具备稳定性指示能力,即不受降解产物,工艺杂质,赋形剂或其它潜在杂质的影响而准确定量的能力,因此可用以下两种方式进行检测方法精密度的研究。
方式1,采用加速6月或长期稳定性样品(效期末)作为代表性均一样品,以测定杂质含量的RSD对方法的精密度进行考察。
方式2,如无法获取上述样品,应采用人为配制100%限度浓度混标样品进行考察,以回收率的RSD对方法的精密度进行考察,通常在无法获取具有代表性的稳定性样品的情况下采用该方法。
3.3、有关物质分析方法验证中溶液稳定性考察是否需要加杂质
建议参照“3.2、有关物质分析方法验证中精密度是否需要加杂质”项下相关要求,开展研究。
3.4、有关物质分析方法验证中耐用性是否需要杂质
系统适用性必须采用限度浓度的混标溶液,对于不同条件下各杂质的含量测定可参照“3.2、有关物质分析方法验证中精密度是否需要加杂质”项下相关要求。
四、结论
分析方法验证中各项可接受标准,各国法规、指导原则并未明确规定,我们在实际工作中应善于总结归纳,深入思考,确保所建立方法的准确性和可重现性。
五、参考文献
[1] 2020版《中国药典》9101、9012
[2] ICHQ2(R1)、USP<1225>、USP<1092>、USP42NF37<1467>
[3] 2010版GMP实施指南
[4] CDE杂质研究电子期刊
[5] 化学药物质量控制分析方法验证技术指导原则。

来源:Internet


