您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-07-27 19:10
获得中国计量认证(CMA)是市场竞争的前提,通过中国合格评定国家认可委员会(CNAS)认可是数据增信、提升实验室知名度的重要途径。在供给侧结构性改革的背景下,建设符合RB/T 214—2017 《检验检测机构资质认定能力评价 检验检测机构通用要求》和CNAS-CL01:2018 《检测和校准实验室能力认可准则》的实验室质量管理体系,成为检验检测机构“以质取胜”的首要选择。
1CNAS-CL01:2018与RB/T 214—2017标准比较分析
CNAS-CL01:2018(等同ISO/IEC 17025:2017《检测和校准实验室能力的通用要求》)评价实验室一致化运作和技术能力属于市场评价行为,RB/T 214—2017是对社会出具证明数据机构的资格认定,带有政府强制属性。RB/T 214—2017编写主要依据GB/T 27025—2019 《检测和校准实验室能力的通用要求》(等同ISO/IEC17025:2017)。CNAS-CL01:2018和RB/T 214—2017条款对照如表1所示,CNAS-CL01:2018和RB/T 214—2017的条款分布虽有差异,但在结构要求、资源要求、条款内容方面基本一致,仅部分条款存在一定的特殊性。CNAS-CL01:2018中:4.1.2节要求管理层进行公正性承诺;4.2.4节要求实验室对活动过程中获得或产生的所有信息保密;6.6.1节注新增了“设备设施维护、能力验证服务”,把分包作为采购服务管理;6.2.6节增加了方法开发、修改、验证和确认,分析结果以及结果报告、审查和批准人员的授权要求;6.5节给出了承认的计量溯源途径并指出校准方案内容;6.6.2节要求进行外部供应商评价、监控表现和再次评价,并对评价结果采取措施;7.2.1.4节将知名技术组织、科技文献或期刊中公布的方法,设备制造商规定的方法列为标准方法;8.1节提供了A+B两种体系方式;8.3.1节注将制造商说明书纳入文件管理。


RB/T 214—2017中:4.2.1节增加了对外部人员监督;4.2.3节要求指定关键管理人员代理人;4.2.6节要求建立人员培训管理程序;4.5.5节限定分包方资质、能力和禁止项目;4.5.12节明确质量负责人策划内审。此外,RB/T 214—2017标准中4.1.4,4.1.5,4.2.1,4.3.1,4.3.4,4.4.2,4.4.6,4.5.3~4.5.17节均明确了建立程序。比较RB/T 214—2017与CNAS-CL01:2018不难发现,两者在公正性、保密性、人员、设施、场所环境、设备、计量溯源性、外部提供的产品和服务、要求、标书和合同评审、方法选择验证和确认、样品管理、结果报告、投诉、不符合工作、数据控制和信息管理、风险和机遇管理、内部审核、管理评审等主要条款内容完全一致。
2 文件化质量体系的搭建
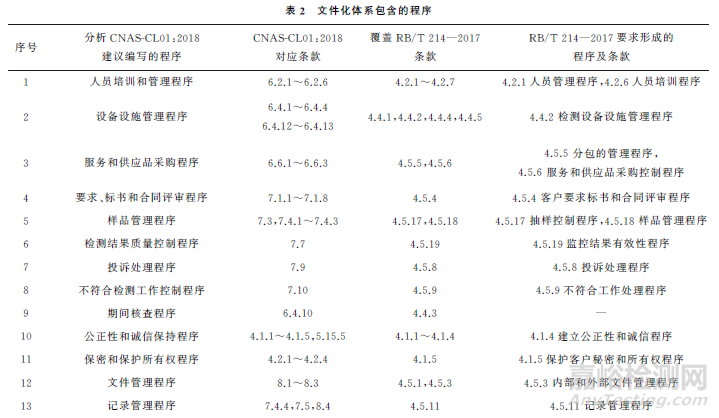
从标准原文要求形成的程序来看,CNASCL01:2018中6.2.5,6.4.3,6.4.10,6.6.2,7.1.1,7.4.1,7.7.1,7.9.1,7.10.1节共要求形成9份程序。此外,考虑到检测结果的形成过程,其他条款融合内容后还可建立公正性和诚信保持(4.1)、保密和保护所有权(4.2)、文件管理(8.2,8.3)、记录管理(7.4.4,7.5,8.4)、方法选择验证和确认(7.2)、计量溯源(6.4.5~6.4.11,6.5)、标准物质和溶液管理(6.4.1)、数据和信息控制(7.11)、结果报告(7.8)、人员监督监控(6.2.3,6.2.5)、内部审核(8.8)、管理评审(8.9)、服务客户(7.1.2~7.1.7)、风险和机遇管理(8.5,8.6)、不确定度评定(7.6)、设施和环境条件控制(6.3)、新检测项目开发和评审(7.2.1.6,7.2.2.3)等17个程序。RB/T 214—2017明确形成了23个程序(见表2),全部包括在CNAS-CL01:2018拟建立的26个程序内。人员培训和管理程序等26个程序完整匹配了RB/T 214—2017的所有条款。因此,建立二合一体系时,基于CNAS-CL01:2018标准编写体系,兼融RB/T 214—2017特殊要求的设计方案可行。若检测实验室已经基于GB/T 19001—2016 《质量管理体系 要求》建立体系,并不证明实验室具有技术上出具有效数据和结果的能力。要保证结果的可靠性和运作一致性,还应增加CNASCL01:2018 中的第4~7 节。如果未建立基于GB/T 19001—2016的质量管理体系,检测实验室要在确定质量方针和目标的前提下,充分引入《检验检测资质认定监督管理办法》重点打击的“四不实、五虚假”风险,融入RB/T 214—2017特殊要求的内容,采用CNAS-CL01:2018体系方式A 编写26个程序,以成文信息规定人员质量职责以及设备设施、环境和方法等实施要求。

3 关键要素的实施策略
3.1 风险和机遇管理
CNAS-CL01:2018 第8.5节和RB/T 214—2017第4.5.10节涵盖了制定措施、体系中整合并实施、评价措施有效性、重新评估再制定的闭环流程。实验室应基于风险思维管控过程和体系,消除或减少非预期结果的风险,有效利用机遇,持续拓展服务能力范围,更好地为客户服务。实验室应将风险管理贯穿业务全过程,通过风险管理PDCA 循环改进,应用风险降级、风险规避、风险转移等策略,确保管理体系能够实现其预期结果。GJB 9001C—2017《质量管理体系要求》提供了运用风险思维的途径,刘慧以GC-MS(气相色谱-质谱联用仪)过程子流程的改进分析,实现了复杂流程的风险管理。实验室由于受到人、机、料、法、环等方面的综合影响,因此其技术、安全和质量风险更大,需要运用过程方法建立管理体系,参考ISO 31000:2018 《风险管理原则和指南》实施风险管理,采用LEC 评价法或FMEA(失效模式及后果分析)等方法开展风险评估。借助标准化检测流程、部署LIMS(实验室信息管理系统)、引入新技术和检测手段等,滚动推进检测活动风险再评价,提升风险向机遇转化的能力。
3.2 人员培训、考核和能力监控
闭环推进人员“选聘-培训-考核-授权-持续评价”,确保人员职业能力符合任务需求。“培训-考核-授权”要求较RB/T 214—2017更为细化,培训时应考虑CNAS-CL01-A002:2020 《检测和校准实验室能力认可准则在化学检测领域的应用说明》有关设备原理的要求,对检测人员开展“准备和安全、旁站观察、文件学习、师傅带授、资格考核”五步评价,对支持和服务人员实施“准备和安全、文件学习、同行评价”三步认可。选聘具有3a以上岗位经历人员从事结果复核等关键技术工作,任命熟悉检测目的、程序、方法和结果评价,具备相关检测经历的人员进行岗位监督和监控。采用问答、笔试、现场见证、实操考核等形式,监督评价新上岗和在培人员的初始能力,对已授权检测人员和关键技术人员开展能力监控。持续评价不限于调阅记录、审核批准报告、质控结果评价、履责失误平衡计分卡等形式。
3.3 确保检测结果的有效性
根据项目的技术难度、方法的熟练程度、方法本身的稳定性与复杂性等,制定覆盖全部检测能力的质控计划,重点监控新增的、对人员经验依赖的、设备变化及技术改变的项目。检测实验室应对监控活动予以策划和审查,监控方案应包括预先偏离判据和处理措施。开展人员、设备、方法比对等内部质控的同时,应积极参加CNAS认可或资质认定部门组织的能力验证或测量审核。检测实验室质量监控手段很多,既可以运用工作标准与相关性分析,也可采用定期添加标准物质、仪器设备比对、标准物质或参考物质核查、测定稳定待测物、留样再测、方法比对、盲样测试等方法。比如用ICP-MS(电感耦合等离子体质谱)测定标准质量控制样结果在标样测量的不确定度区间,就可确认其可信度是否良好。此外,应借助测量值质量控制图和数据统计分析工具掌握检测结果的趋势。
3.4 设备符合规定要求
从使用权益、技术指标和功能3个方面管控设备。设备可以自有也可以租赁,如果检测实验室不是自有设备,应将租赁设备纳入质量体系管理且租期至少2a 以上,可全权支配和使用。CNASCL01:2018中6.4节和RB/T 214—2017中4.4.3,4.4.4节要求建立机制对设备进行校准、维护和检查。实验室应评估设备对结果的有效性和计量溯源性的影响,制定校准方案或检定计划,确认设备的计量溯源结果。满足认可准则6.4.6节描述的两种校准情形的设备必须校准,根据校准证书的信息判断设备是否满足使用要求。检测实验室评估不需校准的设备,应确认其功能或者检定合格状态。设备初次投入使用或者维修后重新投入使用前,均应验证其是否符合规定要求。使用期间设备可能性能退化失稳,可以在相邻两次检定或校准之间实施设备期间核查,以此来保持设备检定或校准状态的可信度,一般采用同等级仪器设备比对、标准物质验证(允许误差限)、留样再测等评价核查结果。
3.5 内部审核策划和实施
体系内部审核是机构自我完善和提高的重要手段。为确保审核的充分性和有效性,实验室应参照GB/T 19011—2021 《管理体系审核指南》要求,由质量负责人基于实验室活动范围、体系分配的质量职责和机构内部管理程序制定年度审核计划。审核前,挑选经过系统培训、具备审核资格并熟悉业务的人员成立审核组,以准备会的形式就以往不符合项进行复盘并记录。审核组成员依据认证认可的标准、内部体系文件的要求制定检查表,内容至少包括:审核要素、文件规定/依据、审查点、对审核发现的描述。现场审核阶段运用关系管理原则,内审员与被评审方应充分沟通。审核员按照审核任务分工,通过查阅记录、面谈、现场考核等方式收集客观证据,考虑职能制约关系和过程要素实施风险,适当横向或者纵向延伸抽取样本。最终内部审核报告由审核组长组织讨论,实验室对不符合项进行确认、分析与评价,形成全员、全过程协同改进机制,实现审核绩效最大化。
4结语
(1) 充分考虑RB/T 214—2017的特殊要求,基于CNAS-CL01:2018设计CMA 和CNAS的二合一体系是可行的。
(2) 经过分析CNAS-CL01:2018后,提出了26个程序文件,能够同时覆盖RB/T 214—2017 和CNAS-CL01:2018的要求,建立的二合一体系可节约时间和成本。
(3) 检测实验室应抓住关键要素,开展人员培训、考核和能力监控,保证设备符合规定要求,确保机构检测结果的有效性。
(4) 检测实验室应结合自身特点有效实施内审,将风险管理贯穿检测相关业务全过程,以保证实验室质量管理体系的持续改进。

来源:理化检验物理分册


