您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-01 06:55
摘要
随着二胎生育政策落实和儿童健康用药需求的不断增长,儿童用药问题引起国家和社会的广泛关注,儿童药物新品种、新规格和新剂型的研发是药学研究工作者和制药企业面临的迫切任务。
本文围绕口服药物液体制剂研发中存在药物溶解性、液体制剂稳定性、辅料安全性和服药的顺应性等技术难点,对已上市儿童口服药物液体制剂的技术特征和目前研究所涉及的药物纳米晶体、自微乳、离子交换树脂和Pickering乳剂等新技术在儿童药物液体制剂研究情况进行讨论分析,以期对儿童口服药物液体制剂的研究开发起到理论指导作用。
关键词
口服药物;儿科学;液体药物制剂;乳剂;离子交换树脂
正文
随着我国二胎政策的落实及医药卫生事业的不断发展,儿童用药问题受到越来越广泛的重视。根据国家统计局数据显示,2019 年我国0~14 岁的儿童总人口约为2.3 亿,占总人口数量的16.8%[1],是一个庞大的人口群体。然而,现阶段我国儿童用药却存在较严重的问题:据资料统计,在我国现有的3 500 余种药品制剂中,明确标识的儿童专用药仅有60 余种,仅占总药品制剂数量的1.7% [2]。同时,我国儿童用药发生不良反应的情况仍然较高:《国家药品不良反应监测年度报告(2019 年)》显示,2019 年药品不良反应/事件报告中,14岁以下儿童患者占10.2%(小于1 岁为2.5%,1~4 岁为3.3%,5~14 岁为4.4%)[3]。面对这种严峻的局面,开发安全有效的儿童药物制剂是药学工作者的当务之急。
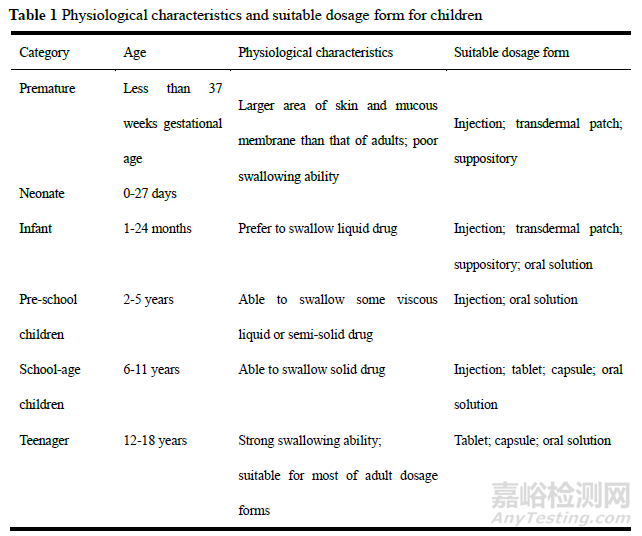
1、儿童生理特点及用药特点
儿童是一个特殊的用药人群,不是“缩小版”的成人。儿童的机体各系统、各器官的功能尚未完善,酶系统尚未完全。因此,儿童的药物代谢速度较成人慢,肾排泄能力也较成人差,比成人更易发生药物的不良反应[4,5]。虽然一些药物在成人临床应用上的效果得到肯定,但是儿童的药效反应可能与成人完全不同。例如喹诺酮类药物中的环丙沙星,虽然在成人药应用中具有良好的抗菌作用,但是在儿童使用中发现,其会对儿童造成软骨损伤,影响骨骼发育[6]。面对这种情况,药学工作者不能直接将成人的用药方式进行简单换算后给儿童使用,需要单独针对儿童的生理特点进行药物设计。
儿童的生长是一个循序渐进的过程,不同生长阶段的儿童呈现不同的生理和病理特点,并且差异较大[7]。因此,在儿童药物开发的过程中,需要考虑到每个年龄段独特的生理学特征而有各自用药特点后再进行剂型设计[8]。根据儿童生长发育的快慢特点,临床上通常将0~18岁的儿童下划分为6类(早产儿、新生儿、婴儿、学龄前儿童、学龄儿童和青少年)。表1汇总了每个年龄段的儿童的生理特点及其对应的适用剂型。不难发现,口服液体制剂由于易吞服和分剂量方便等特点,几乎适用于各个年龄段的儿童患者,同时在使用上也备受广大医师和儿童家长的青睐。因此,儿童用药领域,口服液体制剂有着较大的临床需求。
2、儿童用口服液体制剂的临床使用现状
虽然口服液体制剂在儿童用药领域有较大的优势,然而,目前可使用的儿童口服液体制剂数目依旧较少。根据2013年我国发布的《中国国家处方集-儿童版》,其中儿童口服药物制剂共775种,口服液体制剂(口服溶液剂、混悬剂、糖浆剂、乳剂、滴剂和酏剂)的药物品种只有112种,仅占比14.4%,大多数药物还是以口服固体剂型(片剂、胶囊剂等)为主,缺乏真正适合儿童使用的口服液体剂型 (图1)。另外,相比于其他国家(美国、欧盟等),目前我国儿童口服液体制剂的研发水平相对落后,许多儿童常用药国内也没有口服液体制剂,表2汇总了部分儿童用药物国内外口服剂型的对比。

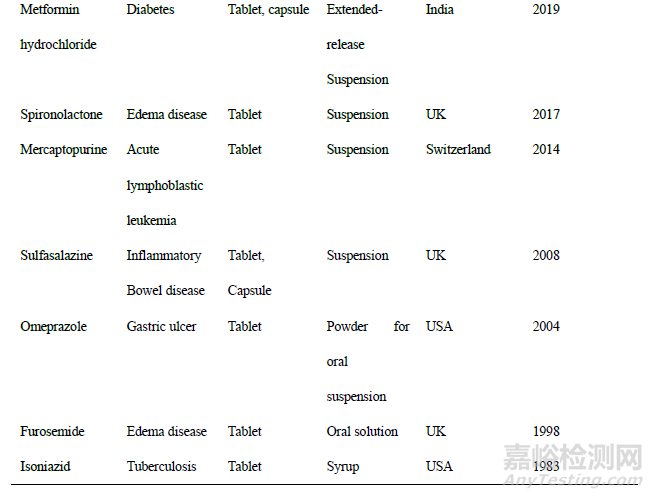
由此可见,我国现阶段儿童口服液体制剂临床使用及研发情况并不乐观,许多儿童常用药物尚未开发出安全有效的口服液体制剂。分析原因在于以下几点:①专业的研究机构和人员较少:在全国6 000 余家药企中,儿童专用药的制药企业仅有10余家,并且儿童药物制剂方向的研发人员也比较缺乏;②液体制剂开发技术难度大:并非每种药物都适合做成液体制剂,这需要进行大量的处方工艺筛选,新技术手段的引入;③制剂质量要求高:儿童口服液体制剂中药物含量的准确性、均一性等质量要求相对较高;④临床试验困难:不同于成年人药物的临床试验,由于受到伦理道德等因素的影响,使得儿童临床试验受试者的招募较为困难。
3、儿童口服液体制剂的技术难点及研发策略
综合儿童用药的特殊性、原料药物化学成分及制剂的性质等多种因素考虑,分析了儿童口服液体制剂的研发中存在的主要技术难点:①药物的溶解性问题;②制剂的稳定性问题;③辅料的安全性问题;④儿童服用的顺应性问题。针对这些技术难点,作者通过文献检索,整理分析了部分儿童药物口服液体制剂的新药研发实例,并结合儿童用药特征和制剂技术难点进行分析讨论。
3.1 药物的溶解性问题
大多数药物在制备成为液体制剂的过程中存在着药物水溶性较差的问题。据统计,在200多种上市的口服药物中,难溶性药物占比40%左右[9]。药物水溶性差的问题不仅会直接影响药物在体内的吸收及生物利用度,还会导致服用的液体体积大大增加,这在一定程度上会增加患儿服用药物的吞咽压力。
3.1.1 传统药物增溶技术
目前大多数上市药物改善药物溶解度的方式主要为传统的药物增溶方式,包括①pH调节法:适用于一些弱酸性和弱碱性药物,通过调节pH值使得药物溶解度增大;②混合溶剂法:在水溶液中加入一定比例的有机溶剂(乙醇、甘油、乙二醇和聚乙二醇等),使得药物达到最大的溶解度;③表面活性剂增溶法:常用于混悬剂和乳剂中,利用表面活性剂的两亲性对药物进行增溶。表3对目前部分上市口服液体制剂增溶方式进行了分析。

3.1.2 药物纳米晶技术
由于溶剂和表面活性剂的毒性问题,使得传统的药物增溶方式受到限制,因此一些药物不能达到有足够的剂量浓度。近几年来,药物纳米晶体是一种新型的纳米递送药系统[10]。通过一定的手段(主要为介质研磨法、高压匀质法等)[11],药物粒子可以在分散介质中被高度分散形成纳米级别的药物晶体。由于纳米级别的药物晶体具有较大的比表面积,根据Ostwald-Freundlich和Noyes-Whitney公式,该技术能够有效地增加药物的饱和溶解度[12],大幅度提高生物利用度[13],在一定程度上可以降低药物剂量,从而减少不良反应的产生。
阿匹瑞坦主要用于预防儿童在化疗过程中引起的恶心与呕吐,其在生物药剂学分类系统中(BCS)中属于IV类药物,具有水溶性差和渗透性差的特点,因此阿匹瑞坦口服液体制剂的开发较为困难。2015年12月,由Merck制药公司专门针对6个月至12岁的儿童患者所开发的阿瑞匹坦干混悬剂Emend®由FDA批准上市。该处方中均采用介质研磨法制备阿瑞匹坦药物纳米晶体,使得药物晶体粒径可降低至250 nm以下,并以低黏度的羟丙基纤维素和月桂酸硫酸钠作为纳米晶体的表面稳定剂,随后进一步制备成为干混悬剂。该处方制剂不仅有效地解决了水溶性问题,且平均生物利用度得到了提高,可达到 60%~65%[14]。
3.1.3 自微乳技术
自微乳给药系统(self-microemulsifying drug delivery system,SMEDDS)是由油、表面活性剂和助表面活性剂或少量水组成的均一透明溶液。将药物溶解分散在油相介质中,口服给药后在含药的自微乳体系在胃肠蠕动下遇体液自发分散形成 O/W 型微乳[15]。该技术不仅可以有效增加药物的溶解度及生物利用度,而且单一油相体系能够有效地增加液体制剂的稳定性。
近些年,在儿童药领域中也有自微乳制剂得到开发。2007年,Pfizer制药公司开发了Anadin LiquiFast®布洛芬液体胶囊。该胶囊中装载了含有布洛芬的自微乳制剂,其处方成分中均为FDA批准较为安全的药用辅料,以中链三甘油酯(medium chain triglyceride, MCT)作为油相、卵磷脂和硬脂酸甘油酯作为表面活性剂、PEG600作为助表面活性剂及棕榈酸抗坏血酸酯作为抗氧化剂。值得注意的是,与传统的布洛芬混悬剂美林TM、Advil®相比,布洛芬自微乳稳定性较好(布洛芬混悬剂使用前需要摇晃均匀)。其不足之处在于仍需要储存于软胶囊中保存使用。
3.2 制剂的稳定性问题
液体制剂通常存在着一定的不稳定性问题,主要包括物理、化学及微生物3方面[16],这些因素在一定程度上会导致药物的变质、失效,从而降低疗效甚至危害机体。物理不稳定性通常发生于混悬剂中,由于混悬剂属于热力学不稳定系统,因此常会发生主药成分的沉降,从而影响到制剂的有效性,使得药物失效或由于局部药物浓度过高而引起中毒反应;化学不稳定性常发生于一些化学性质不稳定的药物水溶液中,通过发生氧化和水解等反应从而出现药物含量和药效降低的问题;微生物不稳定性常发生于多剂量包装的儿童用口服液体制剂,特别是糖浆剂,由于其中通常含有糖成分,很容易引起微生物的生长和繁殖。受到微生物污染的制剂不仅药效会受到影响,而且微生物代谢产生的细菌毒素也会危害儿童的健康[17]。
3.2.1 临配型液体制剂
针对口服液体制剂的物理、化学不稳定问题,目前大多数药物均采用制备临配型液体制剂进行处理[18,19]。抗生素类药物为儿童常用药,然而这类药物如阿莫西林、头孢氨苄和阿奇霉素等由于结构中的β-内酰胺环的化学不稳定性,因此这些抗生素的水溶液极易发生水解反应从而降解,因此市售口服抗生素类药物通常设计成了干混悬剂或干糖浆剂,从而方便储存运输。如Amoxil® (阿莫西林干混悬剂)、Ceftin®(头孢呋辛酯干混悬剂)和 Zithromax® (阿奇霉素干混悬剂)等。这些药物制剂在储存过程中为固体颗粒,使用时,将其水化后能够进行有效分散,形成对应的口服液、混悬剂或糖浆剂。
另外,为了更好地分散上述的临配型药物颗粒或是一些片剂,目前还有一些公司开发了儿童适用的液体分散溶媒[20,21],如Perrigo公司设计的Ora-Blend(口服混悬剂溶媒)和Ora-Sweet(口服糖浆剂溶媒)等;Fagron公司设计的口服液体制剂溶媒SyrSpend SF。以SyrSpend SF为例,其主要成分包括甘油、山梨醇、矫味剂及pH调节剂,将药物粉末加入到该溶媒后,摇晃10~20 s即可形成均匀分散的药物制剂,且在一段时间内不会发生沉降、结块。
3.2.2 非水液体制剂
虽然液体制剂固体化的方式能够有效增加液体制剂的化学稳定性,但是临配制剂的使用会在一定程度上给家长、医师增加许多负担。为了使得儿童用药更加便捷,一些性质不稳定的药物制剂会采用液态多元醇作为溶媒,制备成非水液体制剂。
在儿科领域尼莫地平用于儿童蛛网膜下腔出血后血管痉挛的预防。由于其水溶液会在较高的温度和湿度下发生缓慢降解形成尼莫地平相关杂质A(图1),因此尼莫地平的上市剂型主要为片剂和软胶囊,但儿童使用的顺应性较差。2020年,Arbor制药开发了一种尼莫地平口服液NYMALIZETM,其处方中以聚乙二醇和甘油作为溶剂主体制备了尼莫地平非水溶液剂:其中聚乙二醇质量浓度(w/v)为60%~70%,甘油质量浓度(w/v)为40%~50%。制得的尼莫地平溶液剂不仅方便儿童使用,而且在40℃、75%相对湿度下,3个月中仅有小于5%的药物发生降解,显著地改善了该药物的化学稳定性[22]。
头孢克肟为第三代头孢菌素,抗菌谱广、效果好,主要用于治疗儿童的上呼吸道感染、支气管炎、咽炎和肺炎等感染类疾病。但由于头孢克肟的水溶液稳定性差,目前市售的头孢克肟的制剂通常为片剂、颗粒剂和干混悬剂等固体制剂。专利CN101721363A公开了一种头孢克肟非水混悬剂制备方法[23]。该处方选用麦芽糖醇代替水制备混悬剂。处方中将助悬剂聚维酮 K30 加入到适量的麦芽糖醇中搅拌溶解,再加入草莓香精、尼泊金乙酯的丙二醇溶液,搅拌混合均匀后再加入头孢克肟微粉,高速搅拌分散均匀形成了非水混悬液。这种技术显著地改善了头孢克肟非液体制剂的稳定性,并且由于麦芽糖醇具有甜味,制备的混悬液口感较好,能够有效地掩盖头孢克肟的不良味道。
3.3 辅料的安全性问题
安全性问题是儿童药设计工作中的重中之重。辅料作为药物制剂的重要成分,在药物制剂中发挥着重要的作用。在儿童用口服液体制剂中,为了使得药物更好溶解于水中、具有更好的稳定性及口味,往往会加入一些增溶剂、防腐剂、矫味剂和色素等辅料,而这些辅料可能在儿童频繁用药过程中通过富集效应而产生不良反应,因此需要慎重选择。表4中汇总了一些口服液体制剂中可能对儿童产生不良反应的辅料成分[24-33]。
图片
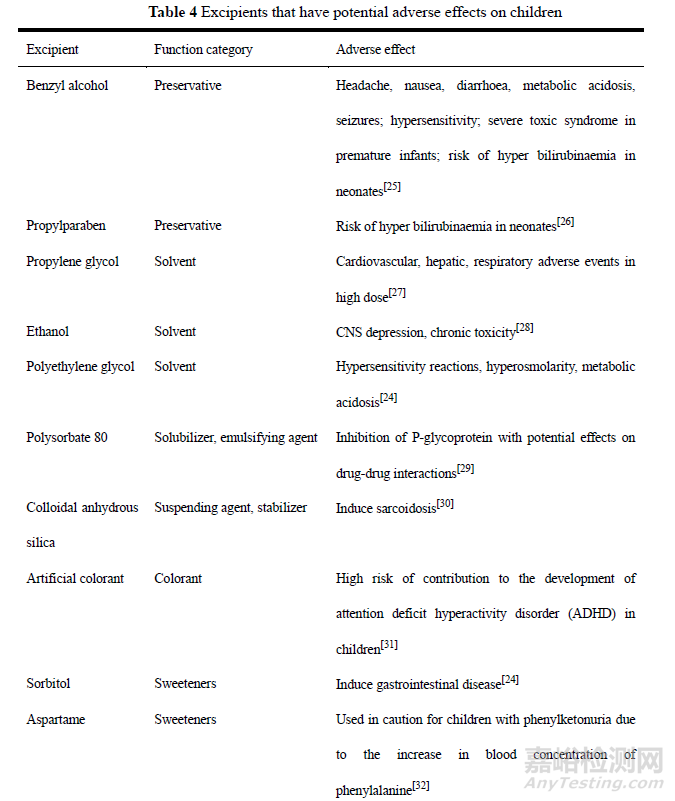

3.3.1 防腐剂替代技术
儿童用口服液体制剂通常含有糖分,易引起微生物的污染,通常会加入一些防腐剂抑制微生物的生长,但是防腐剂的使用又会引起潜在的安全性问题。因此,需要寻找一些安全性的防腐成分来取代传统的防腐剂。乙醇、丙二醇和甘油等作为液体制剂中溶剂使用时,在达到一定浓度范围内,也可以起到一定的防腐作用[24]。但是这些溶剂在使用时需注意用量,否则也会对儿童造成危害[8]。有文献报道,一些无机化合物(碳酸钠、丙酸钙和氧化锌等)也具有一定的抗菌能力,并且毒性较小[34]。另外,一些天然防腐物质包括植物精油、多肽(聚赖氨酸)和多糖(壳聚糖)等也应用于药物制剂领域中[35-37],但由于这类物质在人体内(特别是儿童患者)的安全性无法验证,因此目前应用并不是很多。
3.3.2 表面活性剂替代技术
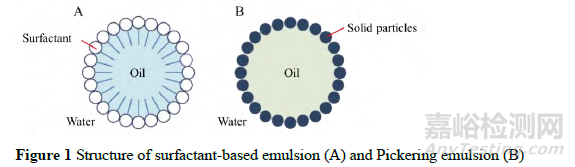
表面活性剂的毒性问题往往是儿童用口服液体药物制剂临床应用的主要制约因素。许多口服液体制剂,特别是混悬剂和乳剂等制剂,为了能够增加药物的溶解度,通常会在处方组成中使用一定量的表面活性剂来改善药物的溶解度,这些表面活性剂的使用常会对儿童用药造成潜在的安全隐患。
然而,Pickering乳液技术恰好能够解决这个问题。普通乳剂是利用表面活性剂的两亲性,在油水两相形成界面膜来降低表面张力,使得体系形成稳定的含药小油滴;而Pickering乳液是利用一些固体微粒(修饰淀粉微粒、SiO2微粒、Mg(OH)2微粒和药物自身纳米晶等)具有降低油水表面张力的能力[38-42],吸附在油滴表面从而形成稳定的乳剂 (图1)。Yi等[43]首先通过高压均质法制备了水飞蓟素纳米晶,并以此作为稳定剂制备了水飞蓟素Pickering乳剂。值得注意的是,整个处方中不需要额外添加任何表面活性剂及稳定剂。该乳剂形成了核壳结构,粒径为(27.3±3.1) μm,在40天内具有较高的稳定性,并展现了较高的生物利用度(水飞蓟素纳米粒的1.6倍,水飞蓟素粗粉的4倍)。虽然该技术展现了一定的临床用药前景,但由于一些固体稳定剂在儿童体内的安全性无法验证,目前暂无临床应用案例,大多数制剂、处方仍处于基础研究阶段。
3.4 儿童口服液体制剂用药顺应性问题
儿童服用液体药物制剂时,首先面临的就是口感问题。在儿童常用药中,许多药物口服使用时常有较严重的苦味。口服液体制剂的苦味问题严重制约了患儿服药的顺应性,在一定程度上影响了治疗的进程。另外,液体药物制剂的给药体积对儿童服药的顺应性也有很大影响。大体积给药可能引起儿童用药摄入药物剂量不完全,导致药效降低,同时也可能造成新生儿的肾代谢障碍问题。近些年来,缓控释制剂是药物制剂的一个发展方向。与普通制剂相比,缓控释技术可以使制剂中的药物以一定的速度缓慢释放,血药浓度更加平稳,减少用药频次,这将有效改善儿童服药的顺应性。
3.4.1 矫味技术
儿童用口服液体制剂研发中常常加入一些矫味剂来改善药物的口感,常用的矫味剂种类包括甜味剂类(蔗糖、果糖等)、芳香剂类(橘子香精、草莓香精等)、酸味剂类(柠檬酸与柠檬酸钠等)和胶浆剂类(羧甲基纤维素钠等)。
在药物研发过程中,通常使用多种矫味剂对制剂进行矫味。Pfizer制药上市的阿奇霉素干混悬剂ZITHROMAX®采用樱桃香精、香草香精和蔗糖进行矫味(甜味剂+芳香剂);布洛芬混悬剂美林TM中就采用羧甲基纤维素、山梨醇和食用香精(甜味剂+芳香剂+胶浆剂)等成分对布洛芬的不良气味进行改良。但是儿童制剂处方中,最好不要含有糖成分,因为它不仅不利于一些特殊用药儿童(糖尿病患儿),而且还会造成正常儿童的龋齿。因此,儿童口服液体处方中处方多采用糖醇类甜味剂(木糖醇、赤藓糖醇等)和人工矫味剂(阿斯巴甜、三氯蔗糖等)进行矫味,这样不仅会改善药物的不良口感,而且还不会对儿童健康问题产生影响。例如,Assertio制药公司上市的双氯芬酸钾口服液CambiaTM采用阿斯巴甜、薄荷-茴香挥发油共同矫味;Kent制药开发的阿莫西林无糖干混悬剂采用山梨醇和糖精钠进行矫味。
3.4.2 颗粒包衣技术
颗粒剂(granules)系指原料药和适宜的辅料混合制成具有一定粒度的干燥颗粒状制剂,是儿童常用的一种口服固体剂型,可直接吞服,也可冲入水中饮服。某些抗生素遇水不稳定,可制成颗粒剂,临用前加水溶解或混悬均匀后服用,如阿莫西林颗粒剂、头孢氨苄颗粒剂。通过将药物颗粒进行包衣的方式可以制备液体缓控释制剂。如市售埃索美拉唑镁缓释干混悬剂NEXIUM®就采用肠溶性甲基丙烯酸树脂材料对药物颗粒包衣;市售二甲双胍缓释干混悬剂RIOMET ER采用乙基纤维素对盐酸二甲双胍药物颗粒进行包衣,这些包衣的药物颗粒可加入木糖醇、黄原胶和微晶纤维素等辅料进一步混合制备干混悬剂。然而,这类制剂属于临配型制剂,使用起来可能没有液体型制剂方便。
3.4.3 离子交换树脂技术
离子交换树脂是一类水不溶性的、带有交换离子活性基团的网状高分子化合物。离子型药物可以与离子交换树脂通过静电吸附作用形成药物-树脂复合物。由于药物-树脂复合物在唾液环境的pH(6~7)环境中比较稳定,且在口腔中停留时间很短,药物几乎不会从树脂上解吸附,因此在口腔中不会感受到药物的苦味。一些药物如雷尼替丁、克林霉素等采用这种方法进行掩味[44]。
药物-树脂复合物进入胃部后,复合物中的离子型药物与胃中大量的H+ 发生置换,释放药物;进入肠道后复合物中的离子型药物可与肠道中Na+ 、K+ 进行置换,释放药物[41]。因此,在口服液体制剂领域中,离子交换树脂不仅可以用来对含有不良味道的药物进行掩味,还是制备液体缓释制剂的重要辅料[45,46]。
Napp制药公司上市的吗啡缓释颗粒MST CONTINUS®采用Dowex 50WX8型阳离子树脂对硫酸吗啡进行吸附,从而实现缓释作用,使得其镇痛能力延长至12 h;上海现代药业的右美沙芬缓释混悬剂(小眉)采用树脂Amberlite GC120与氢溴酸右美沙芬进行吸附,同时处方中加入螯合剂EDTA避免其他离子干扰,该处方同样延长了药效,患者每12 h使用1次即可。
然而,仅用离子交换树脂进行药物包埋,容易发生药物突释现象,部分已上市基于离子交换树脂技术的液体缓释制剂也因此原因撤市。为了进一步提高液体缓释制剂的稳定性,研究人员对药物-树脂复合物进行进一步包衣处理。市售安非他命缓释混悬液ADZENYS ER处方中包括两种含药成分,其中50%为未包衣的药物-树脂复合物速释部分,另外50%为包衣的药物-树脂复合物迟释部分(包衣成分为Eudrigit L100、TEC),两种颗粒混悬于液体介质中形成缓释混悬剂(图2)。患儿服药后,未包衣的药物-树脂复合物首先释放药物,血药浓度迅速提升达到有效治疗浓度,随后血药浓度降低;胃排空后,肠溶衣溶解,因此包衣的药物-树脂复合物开始释放药物,血药浓度再次上升,因此血药浓度-时间曲线呈现双峰形式。这种方式维持有效血药浓度达到10 h左右,患儿每天早上服用1次即可,降低了用药频次,增强了顺应性[47]。

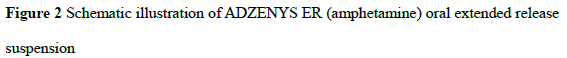
3.4.4 口服微粒缓释技术
微粒缓释技术在口服液体缓释制剂开发中具有很好的应用潜力,其主要包括微球制剂和微囊制剂两种。微球是指药物分散或被吸附在高分子聚合物基质中而形成的微粒分散体系;微囊是固态或液态药物被高分子囊材包裹而成的药库型微型胶囊。微球和微囊制剂都可以用来制备口服液体缓释制剂。
Razdan等[48]利用溶剂挥发法制备了头孢克肟缓释微球。将乙基纤维素、头孢克肟溶解于甲醇-二氯甲烷体系中,缓慢滴加进含有聚乙烯醇(PVA)的水相中,待溶剂挥干后得到微球。优化后的头孢克肟缓释微球可以使得药物释放持续时间达到24 h,有效减少用药频次,研究结果表明,其抗菌效应和生物利用度均是市售的干混悬剂的2倍,展现出不错的临床应用前景。
除基础研究外,Pfizer制药公司于2005年开发了上市产品ZMAX®口服微球(阿奇霉素缓释干混悬剂):将阿奇霉素加入到熔融的甘油山嵛酸酯/泊洛沙姆407混合物中混合均匀,经雾化、冷却后形成阿奇霉素微球。当患儿服用该制剂时,微球中的泊洛沙姆溶解,从而形成孔道,其中的阿奇霉素因此释放;随着阿奇霉素的释放,微球中的孔道继续增加,进一步使得剩余的阿奇霉素释放。阿奇霉素的释放速度可以通过调整甘油酯和泊洛沙姆的比例进行控制。较普通剂型而言,服用阿奇霉素缓释微球后,血药浓度更平稳,提高了用药顺应性[49]。
4、总结与展望
口服液体制剂作为一种儿童适宜剂型,是今后儿童药物制剂的一个重要发展方向。但从目前的临床使用情况来看,我国口服液体制剂品种比较匮乏,甚至一些临床需求较高的儿童常用药都没有合适的口服液体制剂,其中的技术难点如药物溶解度、稳定性、安全性和顺应性问题在一定程度上制约了一些药物品种的口服液体制剂的研发。
本文虽然针对这些技术难点相应地介绍了一些口服液体制剂的开发策略,如药物纳米晶、自微乳技术、Pickering乳剂、离子交换树脂技术和口服微球技术等,但是目前很多技术仍然存在着一定的弊端,限制了口服液体制剂的发展。例如药物纳米晶技术,由于药物纳米晶仍属于热力学不稳定系统,其以液体形式贮存时易产生如沉降、聚集和晶体成长等多种不稳定现象。因此,目前上市的药物纳米晶制剂多采用固体化方式(冷冻干燥、喷雾干燥等)进行贮存,为使用带来一定麻烦。另外,液体制剂缓释技术的不稳定性、突释和泄露等问题仍需要进行关注。
目前,儿童用药的问题已经得到了国家层面的高度重视,先后出台了若干政策文件,以鼓励和加速儿童药物的研发、审批过程。国家卫生计生委办公厅、工业和信息化部办公厅、食品药品监管总局办公厅联合于2016年6月、2017年5月和2019年6月先后印发3批《鼓励研发申报儿童药品清单》(简称《清单》),其中包含口服液体药物制剂45种(口服溶液、口服混悬液、糖浆剂、口服酏剂),并且《清单》涉及的药物品种已经被纳入到了 “十三五”国家重大新药创制专项支持范围。另外, 2019年新修订的《药品管理法》将 “儿童用药品”正式写入法律条款,以立法的方式鼓励药企研制开发儿童药物。因此,药剂工作者需要抓住当下我国儿童药发展的黄金机遇,进一步深入研究,依托新策略、新技术,突破重重技术壁垒,开发出儿童适用且安全有效的口服液体药物制剂,服务于我国广大的儿童用药群体。

来源:凡默谷


