您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-06-08 21:54
2022.6.6,FDA发布了final版EMC指南“Electromagnetic Compatibility (EMC) of Medical Devices”,这个指南是2020年草案指南的更新版,并取代了2016年“Information to Support a Claim of Electromagnetic Compatibility (EMC) of Electrically-Powered Medical Devices”(以下简称2016年EMC指南)。
这则final版EMC指南,适用于电力驱动的,或者含有使用电气或电子电路实现的功能或传感器的MD和IVD设备及其附件。
【过渡期】
IVD设备及附件: 该指南发布后1年,即2023.6.6之后需强制执行;
其他设备及附件:该指南发布后60天,即2022.8.5之后需强制执行。
【过渡期内的审核】
如果本指南中概述的有关电磁兼容性的新信息,未包含在本指南发布前或发布后1年内FDA收到的体外诊断的上市前递交资料中,或未包含在本指南发布前或发布后60天内的本指南范围内的其他设备类型的上市前递交资料中,FDA通常不打算在审查递交资料时要求此类信息。但是,如果提交了任何此类信息,FDA会对其进行审查。
【与2016版EMC指南的主要差异】
1、对递交的EMC信息的要求更明细,尤其是对风险管理,EMC测试过程中的信息(如,医疗器械的配置和功能,在EMC测试过程中做出的产品变更),抗扰度合格/失败准则,基本性能,以及测试结果的信息,要求都很具体。
2、要求考虑认可标准未覆盖到的常见电磁发射器的干扰风险,例如,考虑对 RFID reader、电子安全系统(例如金属探测器、电子物品监控)、近场通信(NFC)系统、无线电力传输(WPT)、蜂窝5G和独特的医疗发射器,如电烙术、MRI、电外科装置和透热设备的抗干扰能力。
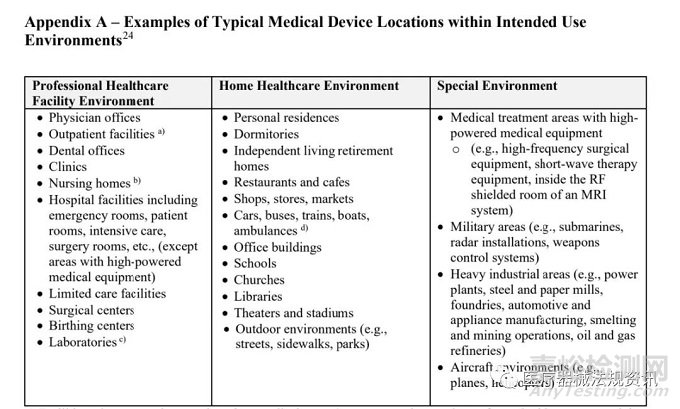
3、详细列举了如下三类使用环境
Professional Healthcare Facility Environment,
Home Healthcare Environment,
Special Environment
见下表:
【FDA注册递交的EMC信息】
FDA建议将下述列出的11项信息包括在递交的EMC部分中,并按照本指南中列出的顺序标记各部分标题。
如果测试报告或测试报告摘要或上市前提交的其他部分包括任何如下信息,应在递交资料的EMC部分注明这些文档中的具体位置。
1. EMC-Related Device Characteristics and Intended Use Environments
2. Assessment of Medical Device Risks
3. Consensus Standards
4. Essential Performance and Immunity Pass/Fail Criteria
5. Medical Device Configuration and Functions Tested
6. Results of EMC Testing
7. Allowances
8. Deviations
9. Modifications
10. Common Electromagnetic (EM) Emitters
11. Labeling
具体要求请见final版EMC指南的章节IV.EMC Information for Premarket Submissions。

来源:医疗器械法规资讯


