您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-23 00:31
药品研发策略和中美欧审评关注点
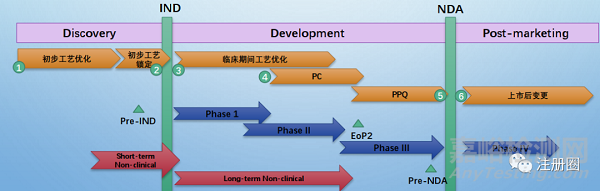
RA工作贯穿药品全生命周期,主要包括:
1. RA/CMC timeline和策略的协同:递交中国/全球的法规要求及技术要求;
2. Pre-IND咨询和IND申请,申报资料准备;审评问题;
3. IND批件对于药品的意见执行,临床期间变更,临床供药;
4. PC、PPQ 策略、临床Protocol/Report等;
5. Pre-NDA咨询和NDA申请:申报资料准备;审评问题,现场核查和注册检验;
6. NDA批件对于上市后的意见执行,上市后变更,降成本的工艺优化、产地变更。
制定合适的注册策略尤为重要,具体包括以下内容:
① 确定药品分类,申报途径(特殊途径)
② 查询竞品信息(审评,发补,上市,数据,结论)
③ 制定临床策略(做,减,免,验证,沟通交流会)
④ 制定技术要求(原液,制剂,原辅包,指导原则,国内国际要求,各国药典),
⑤ 明确审评关注点(同类产品,相似产品,在审产品,欧美审评标准)
⑥ 风险以及时间评估:制剂,原辅包,核查,药检
可参考的法规文件
① ICH CTD;80号文(参考)
② 对应产品的开发指导原则(片剂,注射剂,吸入制剂。)
③ 各国药典(专论,通则)
④ 特定项目的特殊要求(细胞株、杂质等)
⑤ 相关文献(药学审评,非临床以及临床,综述)
⑥ 原辅包状态
申报资料递交后关注项目
① 资料递交受理
② 注册费付费(注意备注)
③ 及时跟踪,沟通项目管理人员以及审评员(发补以及可能的沟通交流会)
④ 药检:样品准备,标准品,检测设备(色谱柱等)
⑤ 现场核查:提前沟通,物料准备,模拟核查。
Tips:根据产品特点,选择有临床试验经验、质量高、IND批准快、临床启动快的国家和基地尽快启动临床。
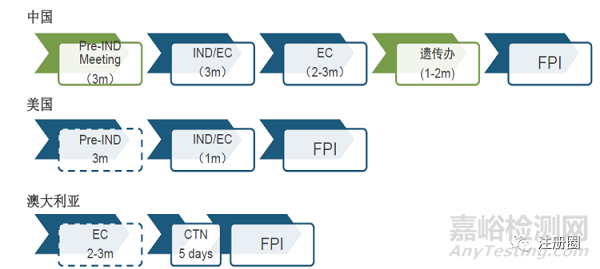
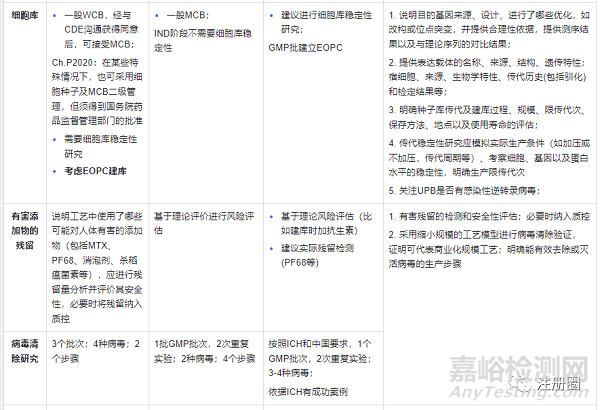
案例:下面以抗体为例,总结中美欧的审评关注点
抗体工艺流程图
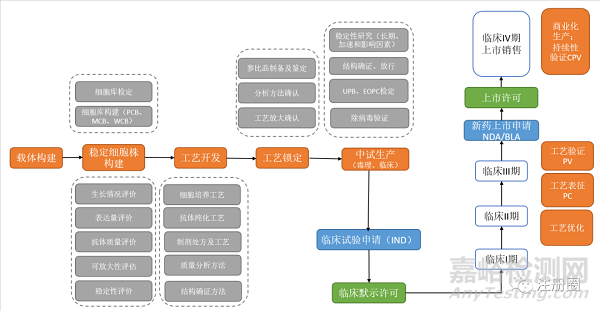
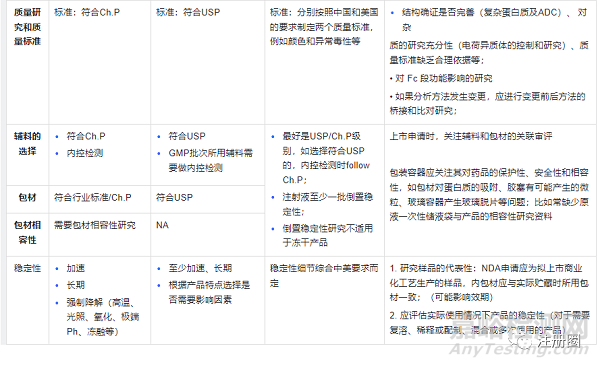
CMC策略及审评关注点
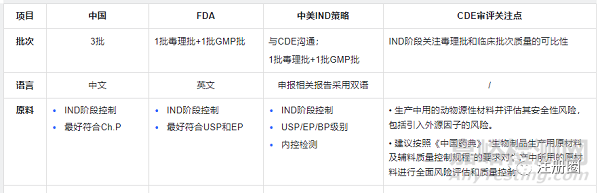
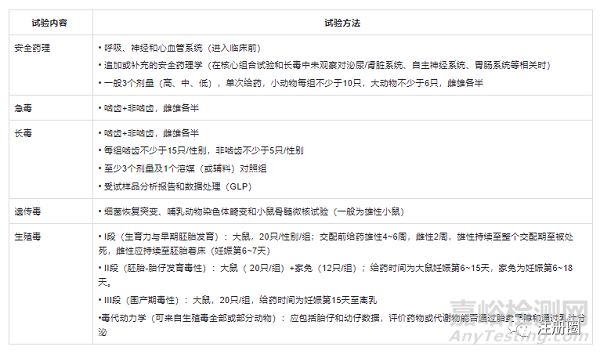
非临床策略及审评关注点(1)


非临床策略及审评关注点(2)
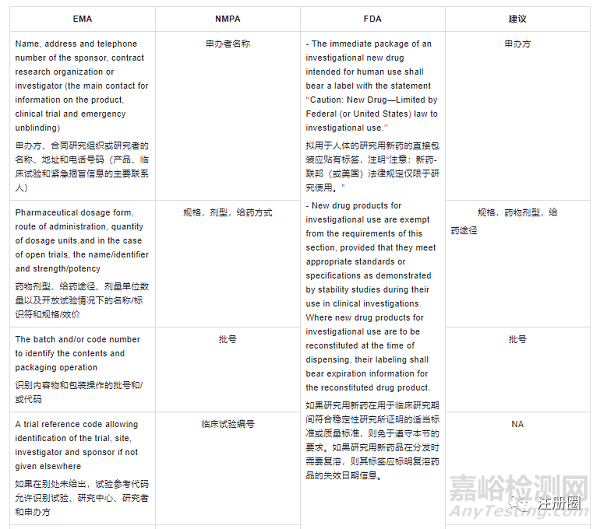
申报资料其他关注点
药用辅料及药包材证明文件
药用辅料及药包材合法来源证明文件,包括供货协议、发票等(适用于制剂未登记原辅包情形)。
药用辅料及药包材使用授权书复印件(适用于制剂选用已登记原辅包情形)。
生产工艺、质量标准、说明书和标签
1.2专利信息及证明文件
专利不构成侵权的声明。应由申请人出具,并承诺对可能的侵权后果承担全部责任。
1.3对照药来源证明文件(如适用)
1.4商标信息及证明文件(如适用)申请商品名的,应当提供商标注册证。
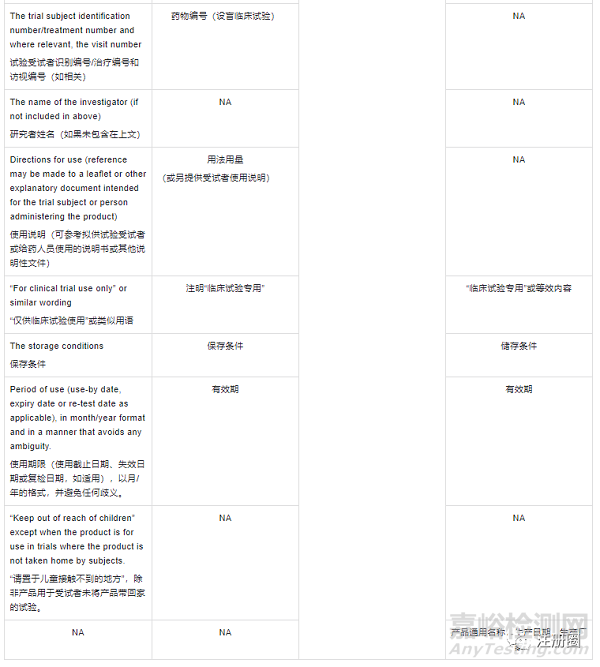
申报资料其他关注点- Labeling(标签)

来源:注册圈


