您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-11-13 21:45
摘 要 / Abstract
目的:针对新修订《药品管理法》假药劣药相关规定的变化,分析其对认定检验带来的影响并提出应对措施。方法:系统对比新旧《药品管理法》在假药劣药范围定义、处罚力度和认定原则等方面的差异,讨论其给药品检验机构假药劣药认定检验带来的影响,并结合实际工作经验提出应对这种变化的建议。结果和讨论:本文结合实际工作经验,从提高检验质量和检验效率两个角度提出可行方案,希望能为顺利应对新修订《药品管理法》假药劣药相关规定的变化提供参考。
Objectives: In view of the changes of the relevant provisions on counterfeit and substandard drugs in the newly-revised Drug Administration Law, this paper analyzed the impact on the identification and testing, and provided some suggestions. Methods: Based on comparisons between the previous and current versions of Drug Administration Law with respect to the definition, punishment and verification principles of counterfeit and substandard drugs, this paper discussed the effects of these changes on the identification and testing of counterfeit and substandard drugs, and proposed some suggestions to deal with this change based on practical work experience. Results and Discussion: based on practical work experience, this paper proposed feasible solutions from the perspective of improving the quality and efficiency of testing, hoping to provide a reference for the response to the changes of the relevant provisions on counterfeit and substandard drugs in the newly-revised Drug Administration Law.
关 键 词 / Key words
药品管理法;假药劣药;认定检验;药品检验机构;检验依据
Drug Administration Law; counterfeit and substandard drugs; drug testing institution; testing basis
新修订《药品管理法》已于2019年12月1日起正式施行[1]。相较于旧版《药品管理法》(2015年版)[2],新修订《药品管理法》在诸多方面均做出了调整,对于假药劣药的监管也提出了更多新的要求[3]。本文通过对比新旧《药品管理法》,从范围定义、处罚力度和认定原则三方面综合分析新修订《药品管理法》假药劣药相关规定的变化以及这些变化给假药劣药认定检验带来的影响,并结合实际工作经验,从提高检验质量和检验效率两个角度进行讨论并提出建议,希望能为顺利应对这种变化提供参考。
01新修订《药品管理法》假药劣药相关规定的变化
1.1 范围定义的变化
随着近些年药品审评审批及监管制度的改革,新修订《药品管理法》对假药劣药的规定范围进行了修订。本文对比了新旧《药品管理法》中假药劣药规定范围的不同,见表1。


新修订《药品管理法》从“假药”“劣药”名称的本质出发对其进行重新定义,将与药品本身相关的违法行为挑选出来,界定为假药劣药,如表1中①~④,共有11类情形。对于与药品本身无关,但与其行政管理相关的违法行为,单独另行规定,如表1中⑤,共有4类情形。这表明新修订《药品管理法》对药品违法行为的分类界定更加严谨,也更加清晰。
1.2 处罚力度的变化
在修订假药劣药范围定义的同时,新修订《药品管理法》还调整了对假药劣药各类违法情形的处罚力度。本文从不同违法主体的角度,对比分析了新旧《药品管理法》中假药劣药处罚力度的差异,见表2。
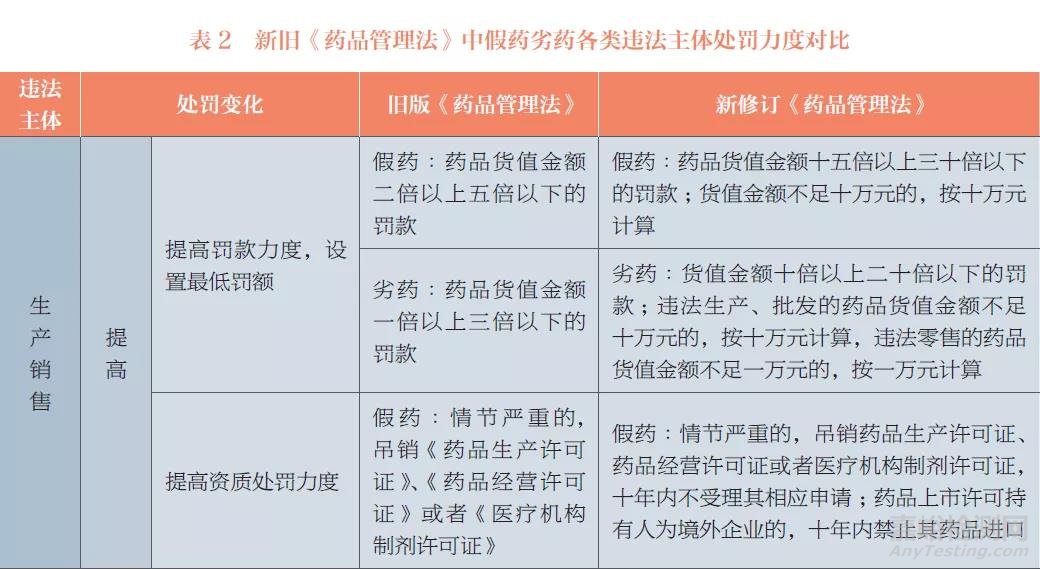
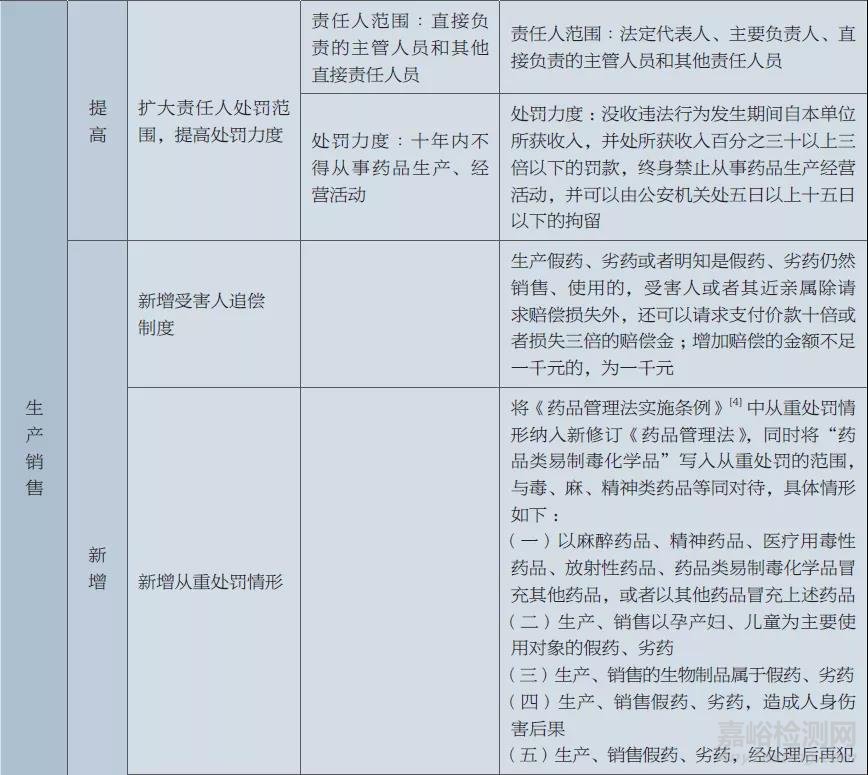
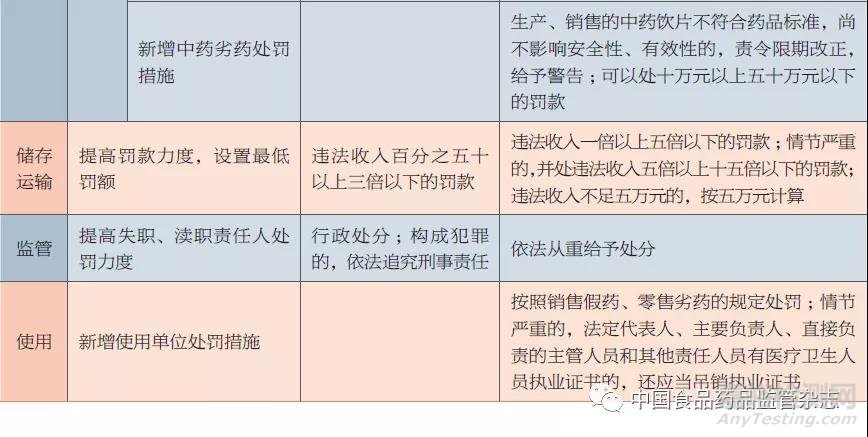
由表2可以看出,新修订《药品管理法》对生产、销售、储存、运输、使用、监管各层面的违法行为均加大了处罚力度:①对生产、销售假药劣药的,新修订《药品管理法》提高了财产处罚额度、资质处罚力度、责任人处罚范围和力度,新增了受害人追偿制度、从重处罚情形以及中药劣药处罚相关规定。②对储存、运输假药劣药的,提高了财产处罚额度。③对查处假药劣药违法行为有失职、渎职行为的,提高了处罚力度,明确从重处分。④对药品使用单位使用假药劣药的,新增了处罚措施。
1.3 认定原则的变化
在提高处罚力度的基础上,新修订《药品管理法》对假药劣药处罚时的认定原则也作了修订。旧版《药品管理法》第七十七条规定:“对假药、劣药的处罚通知,必须载明药品检验机构的质量检验结果;但是,本法第四十八条第三款第(一)、(二)、(五)、(六)项和第四十九条第三款规定的情形除外。”新修订《药品管理法》第一百二十一条规定:“对假药、劣药的处罚决定,应当依法载明药品检验机构的质量检验结论。”删除了排除情形的表述。本文根据上述两条法规,同时结合假药劣药范围定义,对新旧《药品管理法》中假药劣药判决时需出具药品检验机构检验结果的情形进行统计,见表3。
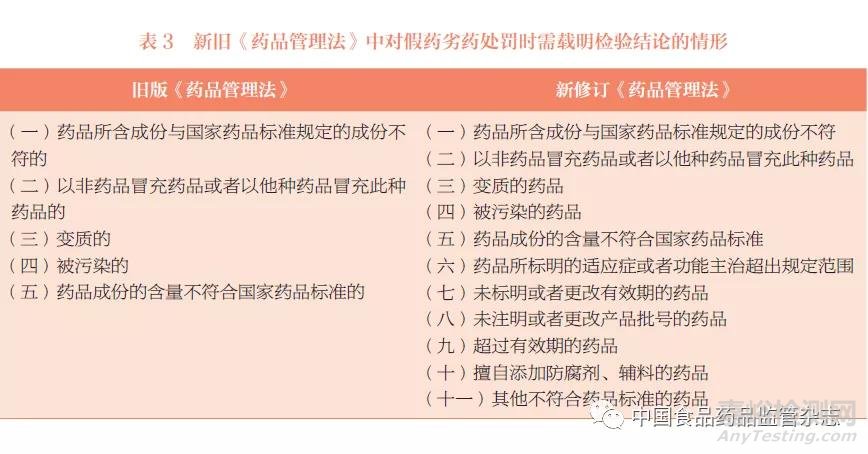
由表3可以看出,对假药劣药进行处罚时,旧版《药品管理法》中仅有5种违法情形需载明药品检验机构的检验结果,而新修订《药品管理法》中有11种,比旧版《药品管理法》多6种。针对这6种情形国家药监局补充发布了《国家药监局综合司关于假药劣药认定有关问题的复函》[5],规定这6种情况只需要事实认定,一般不需要对涉案药品进行检验,处罚决定亦无需载明药品检验机构的质量检验结论。但同时也明确,对违法行为的事实认定,应当以合法、有效、充分的证据为基础,药品质量检验结论并非为认定违法行为的必要证据,除非法律、法规、规章等明确规定对涉案药品依法进行检验并根据质量检验结论才能认定违法事实,或者不对涉案药品依法进行检验就无法对案件所涉事实予以认定。应当根据案件调查取证的情况具体案件具体分析,必要时可以委托相应的药品检验机构进行检验。
以上内容表明,相比于旧版《药品管理法》,新修订《药品管理法》及其配套规范性文件对假药劣药违法行为的认定更加严谨,既要保证司法机关根据事实认定对假药劣药违法行为进行处罚的合法有效性,又要确保必要时药品检验机构及时介入,为案件判定提供科学的质量检验结果。
02应对措施
新修订《药品管理法》从范围定义、处罚力度和认定原则三方面加强了对假药劣药的监管力度,充分体现了国家对于打击假药劣药违法行为的强势态度。在此背景下,药品检验机构作为监管链条中的重要一环,对假药劣药的认定检验将承担更重要和关键的作用,同时也将面临更严峻的挑战,主要体现在检验任务量、检验任务难度、检验时效性和检验结果可靠性等众多方面。因此,要求药品检验机构在进行假药劣药认定检验时,一方面要提高检验质量,为司法判决提供科学、准确和真实的检验结果,以防出现过重或过轻处罚情形;另一方面要提高检验效率,按时完成检验任务,为司法判决的及时性提供保障。
针对新修订《药品管理法》对认定检验带来的影响,药品检验机构应主动作为,及时加强与执法机关和司法机关部门联动,建立精准有效、科学公正、高效运行的衔接程序,为打击假药劣药的违法犯罪行为提供坚实技术支撑。
2.1 从确保检验质量角度分析应对措施
2.1.1 确保样品质量
样品是检验的基础,保证样品的真实性和代表性是保障检验结果科学性、真实性和准确性的重要前提。笔者在实际工作中发现,部分假药劣药认定检验是由公安机关提出的,检验用样品也是由公安机关人员随机抽取并送至药品检验机构的。在这一过程中,存在部分样品数量不足、批次混乱、未进行签封、缺少抽样凭证、储运条件不符合要求等各类可能影响样品真实性和代表性的问题。在新修订《药品管理法》加大对假药劣药和检验机构出具虚假检验报告的处罚力度后,这一问题带来的后果将更加严重。
为避免上述问题,建议药品检验机构和公安机关建立有效沟通衔接机制。具体来说,应建立相应流程,确保公安机关在送检前先与药品检验机构取得联系,确定检验项目和检验用量。此外,也可以请药品监管机构介入,指派具有抽样资质的专业人员参与抽样工作。药品监管机构还可以对公安机关进行样品抽样的相关培训,培养公安系统内有资质的专业抽样人员,具体可参照国家药监局制定的用于药品监督检验的《药品质量抽查检验管理办法》[6]。
需要注意的是,储运温度是影响药品尤其是生物制品质量的重要因素之一,温度过高或过低均容易引起药品有效成分或者杂质的变化[7],导致检验结果不符合药品质量标准。因此,为确保药品检验机构的检验结果能真实反映样品质量,一方面,参与抽样的药品监管机构应特别提醒公安机关相关人员,在运送样品时应按照样品标示的贮藏条件进行储运,当无标识时,可采用该类药品普适的贮藏条件进行储运。另一方面,药品检验机构接到公安机关检验申请时,也应提醒其采取相应的措施或委托具备储运资质的单位来运送样品,以保证样品不变质、不破损、不污染。在接收样品时,应核对其储运温度是否符合贮藏条件的要求。
2.1.2 确保检验依据的科学性和权威性
检验依据是药品检验机构对样品进行检验时所参照的质量标准,该依据的选择直接影响检验结论,因此必须兼具科学性和权威性。在新修订《药品管理法》要求下,面对一些新出现的检验情形,药品检验机构应合理选择检验依据,见表4。
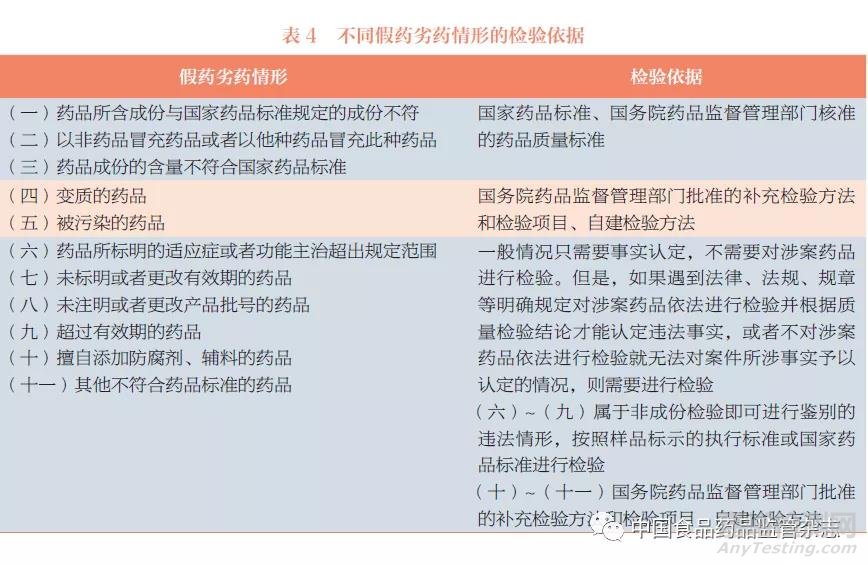
2.1.2.1 优先选择国家药品标准或国务院药品监督管理部门核准的质量标准作为检验依据
新修订《药品管理法》第二十八条规定:“药品应当符合国家药品标准。经国务院药品监督管理部门核准的药品质量标准高于国家药品标准的,按照经核准的药品质量标准执行;没有国家药品标准的,应当符合经核准的药品质量标准。”因此,药品检验机构进行假药劣药认定检验时,如果使用国家药品标准或国务院药品监督管理部门核准的药品质量标准能做出假药劣药认定时,应首先使用此类标准,如表4中(一)~(三)类情形。
2.1.2.2 以国务院药品监督管理部门批准的补充检验方法和检验项目或自建检验方法作为检验依据
对有掺杂、掺假嫌疑等类型的违法情形,依照国家药品标准无法进行假药劣药认定检验时,按照《药品管理法实施条例》[4]的规定,药品检验机构可使用经国务院药品监督管理部门批准的补充检验方法和检验项目进行检验,如表4中(四)~(五)类情形。
但是,国务院药品监督管理部门审核药品检验机构自建的检验方法,将其上升为补充检验方法需要一定的工作程序和时间,容易造成药品检验机构自建检验方法还未获批,而司法机关又急需检验报告的情形。针对此类情形,药品检验机构应制定科学规范的流程来确保自建检验方法的可靠性,同时出具检验报告时应一并提供证明检验方法的准确性、重复性等佐证材料。在最终进行假药劣药判定时,如果有必要,司法机关可以组织相应的行业专家对检验报告及支撑材料进行综合评审,以最大可能保证司法判决的公正性和公平性。
此外,需要注意的是,表4中(六)~(十一)类情形属于一般情况下只需要事实认定,不需要对涉案药品进行检验的情形。但是,如果遇到法律、法规、规章等明确规定对涉案药品依法进行检验并根据质量检验结论才能认定违法事实,或者不对涉案药品依法进行检验就无法对案件所涉事实予以认定的情况,则需要进行检验。如需检验,针对表4中(六)~(九)类情形,因其属于非成份检验即可进行鉴别的违法情形,药品检验机构可按照样品标示的执行标准或国家药品标准进行检验,以供司法机关量刑参考。针对表4中(十)~(十一)类情形,优先采用国务院药品监督管理部门批准的补充检验方法和检验项目进行检验,必要时,可采用药品检验机构自建的检验方法。
2.2 从保障检验效率角度分析应对措施
新修订《药品管理法》第一百一十三条第三款规定:“公安机关、人民检察院、人民法院商请药品监督管理部门、生态环境主管部门等部门提供检验结论、认定意见以及对涉案药品进行无害化处理等协助的,有关部门应当及时提供,予以协助。”笔者在实际工作中发现,为了确保检验结论的权威性,部分公安机关在送检时存在直接向省级甚至国家级药品检验机构送检的情况。考虑到地域空间距离,上述情况一方面会增加公安机关送检的时间成本,同时还会造成基层检验机构资源的浪费和上层检验机构资源的拥堵,最终延长检验报告出具的时间。根据《刑事诉讼法》第九十一条规定,公安机关在查处假药劣药时,对于嫌疑分子的拘留时间是有时限要求的。如果药品检验机构无法按时提供检验报告,会影响公安机关正常执法。因此,从保障检验时间角度考虑,假药劣药的认定检验应全面落实属地管理责任。
新修订《药品管理法》第八条第二款规定:“省、自治区、直辖市人民政府药品监督管理部门负责本行政区域内的药品监督管理工作。设区的市级、县级人民政府承担药品监督管理职责的部门(以下称药品监督管理部门)负责本行政区域内的药品监督管理工作。县级以上地方人民政府有关部门在各自职责范围内负责与药品有关的监督管理工作。”第十一条规定:“药品监督管理部门设置或者指定的药品专业技术机构,承担依法实施药品监督管理所需的审评、检验、核查、监测与评价等工作。”我国药品监督管理部门的设置由高到低依次为国家级,省、自治区、直辖市级、设区的市级和县级。不同层级的药品监督管理部门均设置或者指定药品专业技术机构承担药品监督管理所需的检验、监测等工作。此外,《“十三五”国家药品安全规划》要求[8],要加强国家、省、市三级药品检验检测体系能力建设,保证省级和市级检验机构能够完成监督执法检验任务。因此,药品检验机构应联合药品监督管理部门和公安机关建立属地送检和逐级送检的制度。如果公安机关送检疑似假药劣药样品时,应要求其首先向辖区内市级药品检验机构提出检验申请,若该机构具备该项目检验资质,应接受公安机关的检验申请;若不具备时,应出具委托函委托省级药品检验机构进行检验,以此类推。本文按照监管层级,绘制了公安机关送检流程图,见图1。
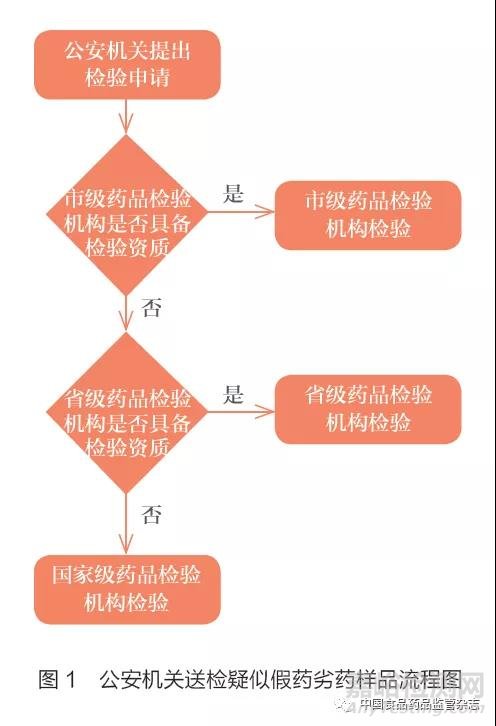
同时,为从根本上保障检验时间,提升检验效率,省级和市级药品检验机构应根据辖区内药品生产、销售和使用情况,不断提升本机构的检验能力,扩充检验资质,为属地监管提供便利。
03结 语
新修订《药品管理法》全面贯彻落实习近平总书记对于药品安全“四个最严”的要求,从各方面加强了对假药劣药违法行为的监管力度。假药劣药认定检验是打击假药劣药违法行为链条中重要的一环,药品检验机构应联合执法机关和司法机关建立科学快速处置流程,尽可能实现从检样收集到检测整个过程各个阶段的规范、高效运转,以提高检验质量和效率。此外,针对在假药劣药认定检验中发现的药品违法行为,药品检验机构也应按照管理层级上报给相应的药品监督管理部门,由其汇总分析上报,以供各级药品监督管理部门监测辖区内药品违法行为,防范系统性、区域性、规律性和有重大影响的药品安全违法行为。

来源:中国食品药品监管杂志


