您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-09 22:35
热湿交换器的管理类别为Ⅱ类,通常由储水储热材料和壳体组成,包括一个进气口和一个出气口,通过保留患者呼气中部分水分和热量,并在吸气过程中将其返回到呼吸道的器械。用于提高输送给呼吸道的气体中的水分含量和温度。
一、热湿交换器的结构与工作原理
1.热湿交换器的结构
产品通常由外壳、滤芯(如有)、热湿交换介质和接口等组成。
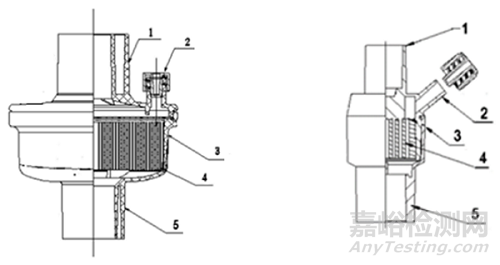
图1. 1-机器端口;2-辅助端口;3-外壳;4-热湿交换介质;5-患者端口
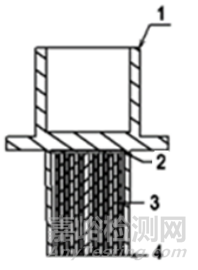
图2. 1-患者端口;2-外壳;3-热湿交换介质;4 -机器端口
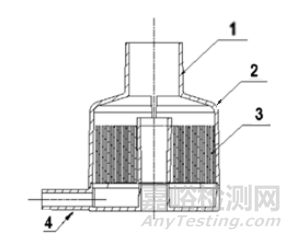
图3. 1-患者端口;2-外壳;3-热湿交换介质;4-辅助端口
2.热湿交换器的工作原理
热湿交换器是一种保温保湿气道管理工具,可以将病人呼出气体中的热量和水分部分地储存起来,再利用这些热量和水分对新进入的气体进行加温及湿化。
呼气时,来自病人的温湿气体进入热湿交换器的内侧面,湿气凝结,同时释放的热量在热湿交换介质中得以保存。吸气时,外部干燥的气体进入热湿交换器,在热湿交换器内得到湿化和温热,然后进入肺内,如此往复循环,不断利用呼气中的热度和湿度来温热和湿化吸入的气体。
产品如声称具有过滤功能,应说明过滤作用(如过滤微粒、细菌及病毒过滤等)及其原理。
二、热湿交换器的研发实验要求
1.产品性能研究
应研究的产品基本性能至少包括YY/T 0735.1-2009或YY/T 0735.2-2010规定的性能。
潮气量小于250mL的热湿交换器,应确定评价方法或者参考YY/T 0735.1-2009或YY/T 0735.2-2010,并调整试验参数。
2.生物相容性研究
应描述热湿交换器与人体间接接触部件的材料,以及接触的性质和时间,参照《关于印发医疗器械生物学评价和审评指南的通知》(国食药监械〔2007〕345号)、GB/T 16886.1-2011《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》的要求对其进行生物相容性评价。
3.灭菌工艺及洁净控制工艺研究
3.1 按GB 18278.1-2015《医疗保健品灭菌 湿热 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》、GB 18279.1-2015《医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》、GB/T 18279.2-2015《医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南》、GB 18280.1-2015《医疗器械保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》、GB 18280.2-2015《医疗保健产品灭菌 辐射 第2部分:建立灭菌剂量》、GB/T 18280.3-2015《医疗保健产品灭菌 辐射 第3部分:剂量测量指南》、GB 18281.2-2015《医疗保健产品灭菌 生物指示物 第2部分:环氧乙烷灭菌用生物指示物》、GB/T 19633.1-2015《最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求》、GB/T 19633.2-2015《最终灭菌医疗器械包装 第2部分:成形、密封和装配过程确认的要求》、YY/T 1267-2015《适用于环氧乙烷灭菌的医疗器械的材料评价》或者适用其他灭菌方式材料评价的标准、YY/T 0698系列标准等要求给出灭菌研究资料。
如果灭菌方式会导致有害物质残留,应进行相关评价。如热湿交换介质等易吸附环氧乙烷,环氧乙烷残留量超标会产生相应危害。
3.2 洁净供应的热湿交换器微生物限度、环境及管理要求及检查方法可结合申报产品的危险性程度和临床使用最不利情况参照GB 15982-2012《医院消毒卫生标准》及《中华人民共和国药典》进行研究。
4.效期和包装研究
4.1 产品有效期和包装研究情况可通过实时老化或加速老化试验获得。加速老化试验可参照YY/T 0681和YY/T 0698系列标准、GB/T 19633.1-2015《最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求》、GB/T 19633.2-2015《最终灭菌医疗器械包装 第2部分:成形、密封和装配过程的确认的要求》。使用的包装材料为医用级别。
4.2 应进行包装研究,依据有关国内、国际标准进行(如GB/T 19633.1、GB/T 19633.2、ISO 11607、ASTM F2475、ASTM D4169等)对包装进行分析研究和评价。直接接触产品的包装材料的选择应至少考虑以下因素:包装材料的物理化学性能;包装材料的毒理学特性;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌或洁净控制过程的适应性;包装材料所能给出的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求(如无菌开启)的适应性;包装材料与标签系统的适应性;包装材料与贮存运输过程的适应性。
5.主要性能指标
5.1.物理性能
一般应包括热湿交换器患者端口接头、附加端口(呼吸辅助装置的接头/呼吸附件接头、辅助端口)、水分损失(不同潮气量的水分损失应予以评价)、压降、气体泄漏、顺应性、外观等。其中气体泄漏、顺应性不适用于连接气管切开插管的热湿交换器。
5.2.化学性能
根据不同材料特性,由企业对化学性能提出要求。用环氧乙烷灭菌的产品应规定环氧乙烷残留量的要求。
5.3.微生物要求
若以无菌形式提供,应进行无菌检验。
非无菌供应一次性使用的产品,若产品使用前不需要进行消毒、灭菌处理,应对其微生物限度进行评价,同时可参考《中华人民共和国药典》中微生物限度检查法进行检测。
三、相关标准
表1. 相关产品标准
|
标准编号 |
标准名称 |
|
GB/T 191-2008 |
《包装储运图示标志》 |
|
GB/T 1962.1-2015 |
《注射器、注射针及其他医疗器械用6%(鲁尔)圆锥接头 第1部分:通用要求》 |
|
GB/T 2828.1-2012 |
《计数抽样检验程序 第1部分:按接收质量限(AQL)检索的逐批检验抽样计划》 |
|
GB/T 14233.1-2008 |
《医用输液、输血、注射器具检验方法 第1部分:化学分析方法》 |
|
GB/T 14233.2-2005 |
《医用输液、输血、注射器具检验方法 第2部分:生物学试验方法》 |
|
GB/T 16886.1-2011 |
《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》 |
|
GB/T 16886.5-2017 |
《医疗器械生物学评价 第5部分:体外细胞毒性试验》 |
|
GB/T 16886.7-2015 |
《医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量》 |
|
GB/T 16886.10-2017 |
《医疗器械生物学评价 第10部分:刺激与皮肤致敏试验》 |
|
YY/T 0313-2014 |
《医用高分子产品 包装和制造商提供信息的要求》 |
|
YY/T 0466.1-2016 |
《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》 |
|
YY/T 0735.1-2009 |
《麻醉和呼吸设备 湿化人体呼吸气体的热湿交换器(HME) 第1部分:用于最小潮气量为250mL的HME》 |
|
YY/T 0735.2-2010 |
《麻醉和呼吸设备 用于加湿人体呼吸气体的热湿交换器(HMEs) 第2部分:用于气管切开术患者的250mL以上潮气量的HMEs》 |
|
YY/T 1040.1-2015 |
《麻醉和呼吸设备 圆锥接头 第1部分:锥头与锥套》 |
|
YY/T 1040.2-2008 |
《麻醉和呼吸设备 圆锥接头 第2部分:螺纹承重接头》 |
四、主要风险
根据YY/T 0316-2016《医疗器械 风险管理对医疗器械的应用》附录E对“热湿交换器产品”已知或可预见的风险进行判定,产品在进行风险分析时至少应包括以下的主要危险(源),企业还应根据自身产品特点确定其他危险(源)。
表2. 产品主要危险(源)
|
危险(源)的分类 |
危险(源)的形成因素 |
可能的后果 |
|
|
生物学危险(源) |
生物污染 |
生产环境控制不好。灭菌操作不严格。包装破损。使用时操作不正规。 |
产品带菌,引起患者使用时感染。 |
|
生物不相容性 |
增塑剂、加工助剂、 环氧乙烷残留量超标 |
产生细胞毒性、致敏反应、急性或慢性毒性。 |
|
|
不正确的配方(化学成分) |
未按照工艺要求配料。小分子物质残留量过大。 |
造成毒性危害。 |
|
|
加工工艺 |
加工工艺控制不严格,后处理工艺控制不严格。 |
引入有害物质,引起患者感染或造成毒性危害。 |
|
|
再感染和/或交叉感染 |
使用不当、标识不清。 |
引起局部或者交叉感染。 |
|
|
环境危险(源) |
储存或运行偏离预定的环境条件 |
储运条件(如温度、湿度)不符合要求。 |
产品老化。 无菌有效期缩短。 |
|
意外的机械破坏 |
储运、使用过程中发生意外的机械性破坏。 |
产品使用性能无法得到保证。 |
|
|
由于废物和/或医疗器械处置的污染 |
使用后的产品没有按照要求集中销毁。 |
造成环境污染或者细菌的交叉感染。 |
|
|
与医疗器械使用有关的危险(源) |
不适当的标记 |
标记不清晰、错误、 没有按照要求进行标记。 |
错误使用。 储存错误。 产品辨别错误。 |
|
不适当的操作说明,如: 与其他器械配合使用不适当;偏离使用说明;说明书关于使用说明不全面 |
包装破损无法识别。 操作要点不突出。
|
无法保证使用安全性。 导致操作失误。 |
|
|
由不熟练/未经培训的人员使用 |
操作不熟练、操作失误。 |
导致延误或不正确治疗。 |
|
|
合理可预见的误用 |
规格型号选用错误。 |
导致无法达到满意的效果。 |
|
|
对一次性使用医疗器械很可能再次使用的危险(源)警告不适当 |
造成重复使用。 |
交叉感染。 |
|
|
不适当不合适或过于复杂的使用者接口 |
违反或缩减说明书、程序等 |
操作方法、注意事项、储存方法、警示事项等表述不清。 |
重复使用引起感染。 没有集中销毁造成环境污染等。 |
|
功能性失效、老化引起的危险(源) |
对医疗器械寿命终止缺少适当的决定 |
没有标识产品有效期。 |
超出灭菌有效期的产品被使用,造成细菌感染。 |
|
不适当的包装(医疗器械的污染和/或变质) |
没有进行包装确认。 |
不能确保产品无菌,从而导致出现细菌感染。 |
|
|
再次使用和/或不适当的再次使用 |
产品标识没有明确只限一次性使用。 |
出现细菌感染、交叉感染以及粘膜损伤等现象。 |
|

来源:嘉峪检测网


