您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2021-07-28 19:55
元素杂质主要是指药品生产或贮藏过程中生成、加入或无意引入的物质。由于药品中元素杂质不能给病人提供任何治疗益处(个别药品除外),而且还可能引发不良反应,或可能对药品的稳定性、保质期产生不利影响,因而建立旨在减少存在于药物中的元素杂质,或者对允许可接受的元素杂质浓度范围进行分析评估尤为重要[1]。2014年12月人用药品注册技术要求國际协调会(ICH)更新关于金属杂质的指南,该指导原则对元素杂质进行了重新分类,监控的元素杂质种类增加至24种,包含了毒性较大的非金属元素如砷、汞、硒及各种常用的金属催化剂、重金属等,并于2015年9月更名为ICH_ Q3D元素杂质指导原则(Q3D Guideline for elements impurities)[2]。自ICH更新Q3D元素杂质指南后,欧洲药品管理局(EMA)和美国FDA相继更新了这一指南,与ICH高度保持一致,由此可见控制的杂质种类已经从传统的重金属扩展到非金属元素,对元素杂质的监控越来越严格,范围也变宽。
无论是ICH_Q3D还是EMA和美国FDA,都说明了元素杂质控制在生产中的重要性,而如何建立科学的控制策略,以有效控制实际生产中元素杂质的风险,保证产品质量显得尤为关键。本文评估分析了原料药生产工艺、设备等因素可能产生的元素杂质,并基于风险评估[3],为药品制订合理的元素控制种类提供参考。
1、元素杂质的分类
基于元素毒性及在药品中出现的可能性,将元素杂质分为三类[4]:
1类:砷、镉、汞和铅,毒性明显,通常来源于矿物赋形剂,药品生产中不得使用或限制使用,所有给药途径必须对该4种元素评估。
2类:有毒性,与给药途径相关。根据元素出现概率,分为2A和2B类。2A类包括钴、镍、钒,这些元素在制剂及设备中出现的可能性较高,需对所有潜在来源和给药途径进行风险评估;2B类元素在药品中出现的可能性较低,除非在生产中有意添加,否则可不评估。
3类:口服毒性低,对注射和吸入给药药品,若给药途径的PDE(permitted daily exposure,允许日暴露)值不超过500 mg/d,则需评估;若该类元素在生产中被有意加入均需评估。
其他:铝、硼、钙、铁、钾、镁、锰、钠、钨、锌等元素,毒性低,未建立PDE,故不进行风险评估,但对其使用量会有一定控制。
2、元素杂质的风险评估
元素杂质风险评估包括3个步骤:①风险识别 识别来源,发现其引入药品的途径;②风险分析 分析各杂质风险水平,判定风险类型和风险控制中的关键控制点;③风险评价 测定元素杂质水平,与建立的PDE比较,评价该元素杂质在药品中存在的可能性及是否需要额外控制,总结评估结果。
2.1 风险识别
基于人、机、料、法、环对原料药生产过程进行鱼骨图分析(图1)
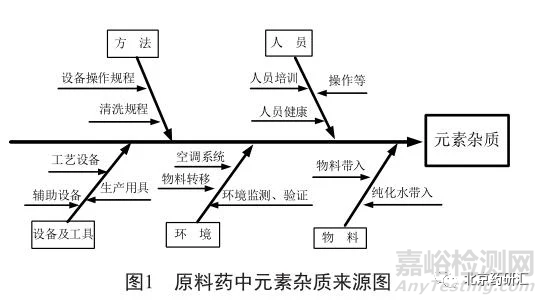
2.1.1 物料因素评估
物料评估包括起始物料、金属催化物、含金属离子的物料、溶剂类、纯化水、内包材。
1)起始物料 基于起始物料的合成工艺,了解是否供应商有意添加金属离子以及起始物料的合成原料中是否带有元素杂质,对于液体类起始物料还需评估其生产设备及包装材料中引入元素杂质的可能性。
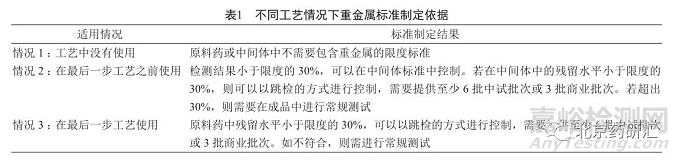
2)金属催化物 金属催化剂是以金属为主要活性组分的固体催化剂,主要是贵金属及铁、钴、镍等元素,该类物质多为需评估的元素杂质。对于有意添加的金属元素,尤其是1类重金属,通常按照表1控制。
3)含金属离子的物料 对于含钠、钾、钙、锌、铁等元素的化合物,该类非ICH_Q3D相关的含金属离子的化合物,可能存在非刻意添加的元素杂质,需考虑带入其他如铅、砷等元素杂质可能性。
对于含银、铜等ICH_Q3D直接相关的元素化合物,为有意添加的金属元素,需结合生产工艺,依据物料的使用工段,按照表1控制。
4)溶剂类 原料药生产用溶剂按化学组成分为有机和无机溶剂,其中有机溶剂一般为醇类、酮类、酯类、醚类、苯类、烃类等,该类溶剂一般不带有金属离子,通常无需评估。无机溶剂如盐酸、硫酸等应基于供应商或自检是否有重金属检测,并根据检测结果确认是否要评估。
5)纯化水 水是原料药生产中常用的无机溶剂,水也是生产设备的常用清洗剂。水是元素杂质引入的一个主要来源,对于由制药用水引入元素杂质的风险,可通过定期电导率及重金属检测,保证水质量,降低杂质引入风险。此外,还需对水系统清洗消毒方式评估,尤其是消毒剂引入元素杂质的可能性。
6)内包材 由内包材引入元素杂质的风险主要在于原料药包括中间体内包装材料释放或粘附的杂质。元素杂质从容器系统中浸出并被引入固体原料药的可能性极低,但对于液体和半固体原料药,该方式引入元素杂质的可能性较高。应对药品最终包装进行相容性及有效性验证,确认重金属残留,降低杂质引入几率。
2.1.2 设备因素评估
绝大多数制药设备是用金属材料制造的[5],在常用材料中不含有1类元素,但涉及部分2A和3类元素,如钴、镍、钼、铬等,其中2A类要进行风险评估,其余应依据制剂的给药途径而定。原料药生产用具多为高分子材料,如聚乙烯、聚丙烯等,该类型材料通常不涉及需评估的杂质元素。
原料药中由设备及生产用具引入杂质元素的风险,主要源于工艺设备在不正常使用下释放出的杂质,如磨损掉屑、腐蚀生锈等,以及在生产过程中与物料直接接触的工艺管道、管配件、密封件带入或释放出的杂质。因此对设备因素引入的元素杂质风险评估需在确认各设备及主要用具的材质基础上,结合生产工艺用溶剂,考虑可能的腐蚀和金属离子携带,还需评估设备润滑剂及管配件、密封件引入杂质的风险性。
2.1.3 方法因素评估
评估主要集中于生产设备及主要用具清洗方法及清洗剂引入杂质的可能性分析。设备清洁通常采用生产中用到的溶剂,清洁剂带入主要基于对清洁剂中元素杂质的确认,对风险较高的清洗剂,需考察末道淋洗液中元素杂质的残留。
2.1.4 人員因素评估
进出人员个人卫生是否按相应规定规范操作。
2.1.5 环境因素评估
环境是否满足GMP对厂房及洁净室的要求。
2.1.6 需评估金属元素
根据“是否有意添加”“物料中可能存在”“设备中可能存在”“其他可能存在”,评估需要进行风险评价的元素杂质。
2.2 风险分析
常用风险评估工具有:失败模式与影响分析模式(FMEA);失败模式、影响和关键点分析(FMECA);预先危害分析(PHA);危险可操作性分析(HAZOP);危害分析与关键控制点(HACCP);故障树分析(FTA)等,其中FMEA是最普通实用的风险分析方法[6]。
FMEA评估风险主要从三方面入手,即可能性(P)、严重性(S)与可检测性(D),通过对三种风险要素明确实施量化评估计算[7]。针对原料药中元素杂质的风险分析,应根据对人、机、料、法、环五大环节对原料药生产过程中可能引入的元素杂质风险识别,对需要进行风险评价的元素杂质进行FMEA评分。其中:①严重性将已识别的危害导致后果分5个级别,可依据元素杂质相应的PDE值进行评分。以实际制剂引入杂质严重性程度进行评估。②可检测性 将按照问题可被查出的难易程度分4个级别,可依据元素杂质的检测情况进行评分,7分:无检测控制;5分:首批或首次进行元素含量确认;3分:定期检测;1分:供应商或自检每批检测。③可能性 将已识别的危害发生的可能性即发生频率分5个级别,其中数值1,表示失败不可能发生;数值2,表示发生可能性很小:只发生过一两次失败;数值3,表示偶尔可能发生:失败潜在性很小;数值4,表示很有可能发生:已注意到潜在危害,需额外工艺控制以避免失败;数值5,表示经常发生。可能性评分,基于对生产工艺的了解和有关验证,主观评价有关元素杂质引入的可能性。
评价准则:风险评估小组将风险值与预先设定的风险既定准则进行比较,确定风险等级,风险等级划分为高、中、低三个等级,风险值=严重性×可能性×可检测性(表2)。

2.3 风险评价及控制
根据风险评分表,对中高风险下元素在原料药中的存在水平,制定相应控制策略。
2.3.1 元素杂质的检测方法
目前,各国药典收载的药品元素杂质检测多采用“重金属限度检查法”,该方法所得结果只是样品中各元素杂质的总量值,不能对单个元素杂质定量分析。近期,美国药典正式批准了元素杂质新通则<232>“元素杂质-限度”和<233>“元素杂质-方法”的修订,推荐了电感耦合等离子体原子发射光谱法(ICP-AES法或ICPOES法)和电感耦合等离子体质谱法(ICP-MS法)[8],这两种方法有较高的灵敏性和准确性,可以检测出药品中更低残留量的元素杂质,是目前元素杂质评估分析的主要检测手段。
2.3.2 元素杂质的控制
一个元素杂质的控制阈值为制剂中该元素PDE的30%[9],如果制剂中所有来源的该元素杂质总水平始终小于PDE的30%,则表示目前控制方法有效,无需对该元素额外控制。原料药中元素杂质的控制阈值可参照制剂进行评估。
因不同金属杂质发挥毒性的部位不同,故不同给药途径的PDE不同,根据原料药的制剂类型及其制剂最大日摄入量,通常基于如下公式计算原料药中该元素杂质的安全限度。
安全限度=PDE(mg/d)/最大日剂量(mg/d)
控制阈值(mg/g)=安全限度×30%
针对原料药中高风险的元素杂质,可选择连续3批商业批次原料药,评估相应元素杂质的存在水平,制定相应控制策略。若检测水平远小于控制阈值,则表明已采取的实施措施可行,无需再进行额外控制;若检测水平高于控制阈值,可根据该元素的风险评估,针对其风险项做相应控制,如:原辅料中带入,可通过在原辅料标准中建立相应元素杂质限度;设备清洗引入,应对清洁剂、清洁方法进行确认,选择合适的清洗工艺;对于有意添加的元素,使元素杂质降低至控制阈值以下;对于制药用水引入,可通过避免使用自来水,增加实时电导率監测及纯化水重金属检测频率,加强制药用水水质的监控。
3、总结
本文根据元素杂质指南,评估生产工艺及设备等因素引入元素杂质的风险性,并通过对中高风险元素杂质的含量测定,以制定相应控制策略,将风险降低到可接受水平。2017年6月中国正式加入ICH,ICH_Q3D作为元素杂质的主要指南,是中国化学原料药走向国际市场必须符合的硬性条件。在原料药控制中应尽快对元素杂质进行风险评估,建立相应的、在国内外申报中均能得到认可的原辅料元素限度。参考文献
[1] 姜小林, 董素萍, 舒靖能. ICH_Q3D新药制剂元素杂质评估及控制的要点解读[J]. 中国药事, 2017, 31(8):854-860.
[2] 李叶, 于宗贵, 张杰, 等. 原料药国际认证中对元素杂质的要求[J]. 机电信息, 2017(32):16-18.
[3] 陈金利, 刘艳花. 质量风险管理在制药业的应用[J]. 化工与医药工程, 2012, 33(2):32-35.
[4] ICH (International Conference on Harmonization) Guidelines, Q3D. Guideline for elements impurities [EB/OL]. [2018-04-10]. https://www.fda.gov/downloads/drugs/guidances/ ucm371025.pdf.
[5] 周立法, 江培, 曹丽娜. 制药设备设计制造对“ICH Q3D元素杂质指导原则”的响应[J]. 机电信息, 2016(35):1-7.
[6] 陈铖. 质量风险管理在制药中的应用探讨[J]. 化工管理, 2016(1):151.
[7] 黄晓丽, 宋雅丽. 质量风险管理在制药中的应用[J]. 河北化工, 2012, 35(9):22-24, 42.
[8] 张慧敏, 余灵芝, 陈旭, 等. 《美国药典》新通则〈232〉和〈233〉元素杂质控制新标准和方法介绍及其对医药界的影响[J]. 中国药房, 2014, 25(17):1601-1604.
[9] 李叶, 于宗贵, 张杰, 等. 原料药国际认证中对元素杂质的要求[J]. 机电信息, 2017(32):16-18.

来源:北京药研汇


