您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-04-27 19:15
最终的医疗器械中可能存在各种各样的化学成分,例如各种添加剂,包括润滑剂、染色剂、粘合剂以及灭菌过程中产生的灭菌剂残留物等,应考虑这些成分是否具有潜在的刺激活性。刺激的特征会表现为发炎、发红、肿胀、发热和疼痛。因此,刺激性测试对于评估医疗器械暴露于人体后立即引起刺激性反应的潜力至关重要。刺激性测试包括皮内反应、皮肤刺激、眼刺激、黏膜刺激测试,当器械不适用于该设备的使用(眼睛、皮肤或黏膜)时,像植入类器械和外部接入器械,则需要选择皮内反应试验,皮内反应试验是一种体内试验,通过对皮内注射医疗器械的浸提液来评估引起刺激的可能性。
一、试验目的
评定从医疗器械中释放出的化学物可能引起的皮肤接触性危害。
二、测试方法
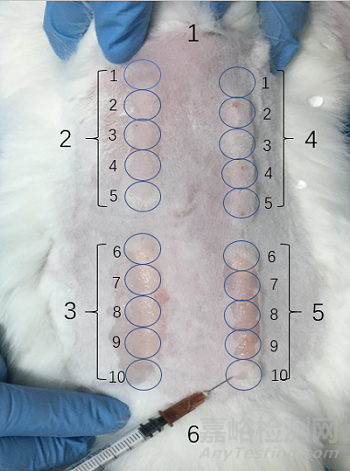
通过兔皮内注射法评价检测样品导致皮内刺激的潜在性。使用极性浸提介质(0.9% 氯化钠溶液)和非极性浸提介质(芝麻油)浸提检测样品。分别将每种浸提液注射到在3个动物背部一侧皮下5个不同位置,每个位置注射0.2ml。同样地,将每种浸提介质(对照组)注射到每个动物背部的对侧(点位分布见图1)。注射后,立即观察注射部位。并于24、48和72小时内观察红斑和水肿现象并评分(见表1)。
★图1 注射点排列
说明:1-头端, 2-0.2 ml 极性浸提液注射点, 3-0.2 ml 非极性浸提液注射点,4-0.2 ml 极性介质对照注射点, 5-0.2 ml 非极性介质对照注射点以及6-尾端。
表1:皮内反应记分系统
反应
记分
红斑和焦痂形成(ER)
_
无红斑
0
极轻微红斑(勉强可见)
1
清晰红斑
2
中度红斑
3
重度红斑(紫红色)至无法进行红斑分级的焦痂形成
4
水肿形成(OE)
_
无水肿
0
极轻微水肿(勉强可见)
1
清晰水肿(肿起边缘清晰)
2
中度水肿(肿起约1mm)
3
重度水肿(肿起超过1mm,并超出接触区)
4
刺激最高记分
8
应记录并报告注射部位的其他异常情况。
_
三、结果评价
统计分析原始数据,得出试验结果。如果试验样品最终记分不大于1.0,则符合试验要求。
四、相关标准
1) ISO 10993-10:2010 Biological evaluation of medical devices – Part 10: Tests for irritation and skin sensitization;
2) GB/T16886.10-2017 医疗器械生物学评价 – 第10部分:刺激和皮肤致敏试验;
3) GB/T14233.2-2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法;
4) GB/T 16175-2008 医用有机硅材料生物学评价试验方法;
5) EN ISO 10993-10:2010 Biological evaluation of medical devices – Part 10: Tests for irritation and skin sensitization;
6) ISO 7405-2018 Dentistry — Evaluation of biocompatibility of medical devices used in dentistry.

来源:Internet


