您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-27 14:17
QbD是一个科学技术及质量风险管理相结合的系统性研发方法,它始于预先制定好的目标,强调对产品和生产工艺的理解及控制。QbD从患者对药品的临床需求着手,先确定药品质量的目标概况(QualityTargetProduct Profile,QTPP),形成产品开发设计的基础。
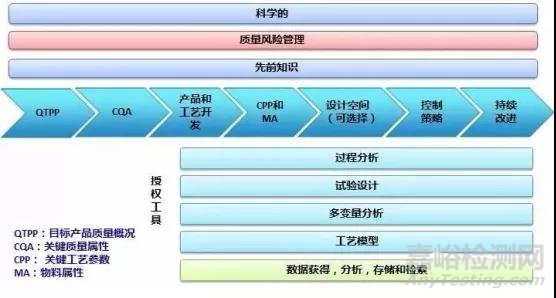
QTPP是QbD的基本元素,是从理论上进行前瞻性总结某个产品的质量属性,以确保最终药物在临床上的安全性与有效性。QTPP 主要考虑临床使用条件、给药途径、剂型和药物传递系统、药动学参数或生物等效性、剂量规格、药品包装材料和形式等因素。
举个例子
对于一个注射剂,需要考虑:在临床使用时是否需要溶于溶液稀释后再给药?稀释溶液pH是否会影响药物稳定性?如果该药品是滴注给药,那么多长时间放置,可以保证药物的稳定性?还要考虑到:如果病床靠近窗口,在太阳的照射下,滴注样品仍然需要稳定等。QTPP通常需要公司的各部门一起讨论,并由各部门批准。除了制剂开发部门,还包括临床研发部门、临床前研究(药代和毒理研究)部门、药事法规部门、工业生产部门等,如果从药品研发初始阶段就在脑海中形成QTPP的概念,那么,最终我们可获得一个稳健的处方及生产工艺,并且能保产品的关键质量属性。
QTPP明确之后,便要查询相关资料,或开展试验来确定药物的理化和生物学性质(即处方前研究),再结合医学、市场、运营、法规需求,确定生产出质量稳定、疗效可靠产品的关键质量属性(CriticalQuality Attributes, CQA)。关键质量属性反映的是成品在内的产出物料(中间体)的某种物理、化学、生物学等性质或特征,当这一性质或特征在一个适当的限度、范围或分布内,才能确保预期的产品质量。对口服固体制剂(oral soliddosage,OSD)质量属性包括其有效成分鉴别、含量、含量均匀度、降解产物、残留溶剂、药物释放或溶出度、水分含量、微生物限度,以及物理属性,如颜色、形状、大小、气味、产品刻痕和脆碎度等。在这个过程中,会形成CQA报告,关键质量属性的认定需要得到整个开发团队(药企各部门)的认可。根据这些关键质量属性和处方前研究报告,制剂开发团队将起草制剂产品开发策略,在得到制剂部门管理层认可后,进入产品开发阶段。
OSD药品的这些质量属性可以是关键的质量属性(critical quality attributes,CQA),也可以是非关键性的。一个质量属性是否关键,取决于当该属性超出可接受范围时对患者引起的伤害程度,应该依据化合物的特性和制剂剂型的特点确定制剂产品的关键质量属性(CQA)。
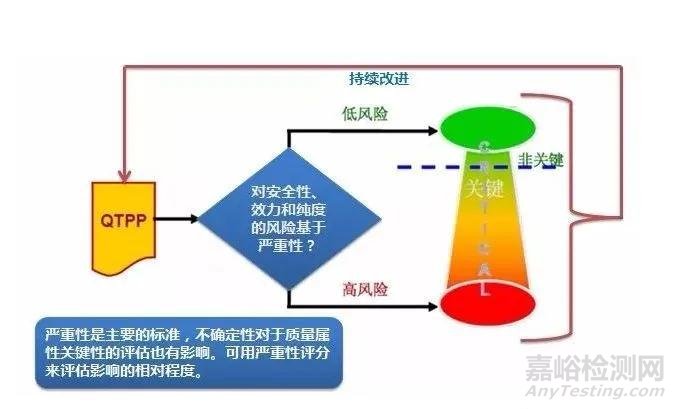
QbD中对QTTP和CQA的研究确定是围绕患者的需求和对患者产生的影响来决定,并以临床疗效和安全为目标。QTPP与CQA可以是包含关系,从QTPP中挑选出CQAs的关键在于如果某种属性超出了范围时,由风险评估获得的该属性对病人是否有重大影响。
对于仿制药而言,QTTP和CQA通常是通过研究参比制剂的说明书以及参比制剂的质量属性等来确定。参比制剂的研究包括但不限于以下内容:了解参比制剂的适应症、适用人群、用法用量、最大日剂量、药理作用、药动学以及辅料成分等;进行必要的逆向工程研究参比制剂可能的处方组成和工艺;进行必要的检验从而了解参比制剂的各项质量属性如含量、杂质、有机残留、水分、硬度、崩解及溶出等。
小试开发
产品开发首先要在小试规模进行。由于在这个时期的原料药来源非常有限,制剂开发通常以配方研究为主,伴以手工制备。主要根据物理药剂理念,探索哪些原料药的性质、辅料性质以及不同制剂概念将会对制剂产品的关键质量属性有显著影响,同时对技术瓶颈攻关。对于一些新型制剂的功能需求,还需考虑添加功能辅料。需要注意的是,功能辅料的选择必须在FDA公布的“质”和“量”的范围。
工艺开发
在小试开发基本达到开发要求,所制备的产品基本符合产品关键质量属性要求后,制剂开发工作进入工艺开发阶段。在此过程,主要是根据产品关键质量属性,确定生产工艺路线,同时根据工艺的需求调整辅料。工艺开发的主要成果是确认关键工艺步骤及其工艺参数范围。值得一提的是,在制剂开发过程中,随时需要考虑产业化的可行性。比如,制剂研发人员应尽量选用成熟、重现性好、简单、低成本工艺。选择的工艺及设备需要得到生产部门的确认,所选择的辅料需与生产部门一致。笔者的经验是,制剂开发部门最好使用生产部门的辅料进行处方开发和工艺开发,选择的生产工艺及设备需要考虑生产部门的可行性。比如笔者曾经历过的情况,由于日本与美国对PEG6000的定义不同,同一公司内部不同部门使用不同辅料,造成技术转移时出现困惑。所以,若不关注辅料来源,必然会影响到研发阶段与上市后批量生产时产品的质量差异。
工艺放大
在制剂产品的工艺路线确定后,产品开发进入工艺放大阶段。在这个阶段,主要根据中试生产和商业生产批次规模,对关键工艺参数进行优化,同时也会根据工艺的需求进一步调整辅料;也运用数学模型、统计方法等(如可能,运用在线分析系统PAT),确认关键工艺步骤及其参数范围,在此过程中还有必要在关键工艺步骤的参数范围边缘生产批次;确认关键工艺步骤所可能产生的风险,并建立风险控制步骤。
技术转移
制剂开发的最终目的是将所开发的产品处方和工艺移交给生产部门进行生产,这个制剂研发部门与制剂产品生产部门的交接过程,称为技术转移。通常,技术转移首先需要起草技术转移方案,应根据公司规定的模版,先由制剂研发部门起草,然后由生产部门审阅,并由双方签字确定。如生产工艺比较复杂,可由研发部门进行预生产一定的批次量,再转移给生产部门。技术转移一般生产三批:第一批由研发人员负责生产,称为演示批;第二批由双方共同负责生产,称为交接批;第三批由生产部门负责生产,称为验收批。
后记
所有的质量属性都是产品的目标元素,这些属性可以是关键性的,也可以是非关键性的;但它们均应该通过一系列好的质量管理体系、合适的处方、以及工艺设计来获得。在药物研发过程中,我们一般仅关注那些会受处方、工艺影响较大的一些CQAs。

来源:Internet


