您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-30 16:08
今日头条
年度“明星”小分子药物榜单出炉。猎药人(drughunter)网站日前公布了由行业药物开发人员选出的年度小分子榜单,体现了行业专家对在研小分子药物的评估。投票结果显示,吉利德科学(Gilead Sciences)的长效HIV衣壳抑制剂lenacapavir(GS-6207)位列第一,葛兰素史克降解RIPK2蛋白的靶向蛋白降解剂PROTAC 6位居次席,拜耳的人促性腺激素释放激素受体(hGnRH-R)拮抗剂BAY 1214784和Mirati Therapeutics公司的KRAS G12C抑制剂adagrasib(MRTX849)并列第三。
国内药讯
1.石药首创新药JMT601国内获批临床。石药集团首创新药JMT601获国家药监局临床试验默示许可,拟开发用于非霍奇金淋巴瘤(nHL)的治疗。JMT601是一款基于抗CD20抗体奥法木单抗并透过加入CD47结合片段SIRPα而合理设计的新型双特异性融合蛋白。临床前实验表明,JMT601对CD20阴性的细胞无明显结合,100 mpk剂量下未见红细胞、血小板等CD47强阳性细胞显著受累,安全状况良好。公司还计划在美国进行JMT601的Ⅰ期临床试验。
2.恒瑞ERK抑制剂获批临床。恒瑞医药1类新药HRS2543片获国家药监局临床试验默示许可,拟用于治疗晚期恶性肿瘤。HRS2543是一款ERK抑制剂。ERK激酶是MEK激酶的唯一下游靶点,靶向于ERK靶点的抑制剂能够有效阻断RAS-RAF-MEK-ERK信号通路,同时能够有效逆转由上游BRAF、MEK突变而导致的耐药。此前国内同类产品已有贝达药业的BPI-27336 、中科院与上海海和联合开发的HH2710以及和记黄埔的HMPL-295S1获批临床。
3.圣和药业中美双报品种SH3765片国内申报临床。圣和药业1类新药SH3765片临床试验申请获CDE受理。SH3765是一款靶向PRMT5的小分子抑制剂,已在体外酶活性抑制试验、细胞活力抑制试验以及基于人淋巴瘤细胞、人乳腺癌细胞、人非小细胞肺癌细胞的小鼠体内异种移植瘤动物模型的药效评价试验中显示出初步的抗肿瘤活性。该新药拟用于治疗晚期恶性肿瘤,包括但不限于实体瘤、非霍奇金淋巴瘤等。今年2月,SH3765已获得美国临床试验许可。
4.贝达PD-1巴替利单抗国内申报临床。贝达药业PD-1巴替利单抗(Balstilimab)的临床试验申请获CDE受理。Balstilimab是贝达药业从Agenus公司引进的2款单抗产品之一,另一款是CTLA-4单抗Zalifrelimab。在美国,Agenus已于2020年9月向FDA递交巴替利单抗上市申请并获FDA快速通道资格,单药或联合CTLA-4单抗 Zalifrelimab 用于治疗晚期/转移性宫颈癌患者。一项2020年发表于ESMO上的Ⅱ期临床(NCT03104699)结果显示,Balstilimab单药治疗ORR为 14%,DOR为15.4个月。
5.复宏汉霖获润新生物BRAF抑制剂中国区授权。复宏汉霖与润新生物就BRAF V600E抑制剂RX208达成一项独家许可合作。RX208是润新生物开发的“Best-in-Class”小分子抑制剂,已在早期临床中展现出初步疗效和较低的副作用;并有潜力与复宏汉霖的EGFR、PD-1靶点的单抗产生协同效应。根据协议,复宏汉霖将获RX208在中国(包括香港、澳门和台湾地区)开发、生产和商业化权益;润新生物将获9750万元的首付款、约10.8亿元的里程碑付款以及产品的销售提成。
6.法国暂停康弘药业康柏西普眼用注射液KHB-1802项目。康弘药业3月28日晚间发布公告表示,法国国家药品与健康产品安全局(ANSM)目前已暂停“一项多中心、双盲、随机、剂量范围试验,评估康柏西普眼用注射液治疗新生血管性、年龄相关性、黄斑变性患者的疗效和安全性”临床试验项目的试验二(KHB-1802)。康柏西普是一种特异性抑制血管新生的受体抗体融合蛋白,公告中尚未透露项目暂停的原因。该公司表示将与ANSM沟通并按相关规定和要求开展后续工作。
7.复宏汉霖2020年收入增长5倍。复宏汉霖公布2020年财报,全年收入5.876亿元,同比增长546%,主要来自于药物销售、向客户提供的研发服务及授权许可收入。其中,中国首个生物类似药汉利康(利妥昔单抗)销售利润分成收入是2.88亿元,相比2019年的7900万元增长了265%(综合推测其终端销售收入达到7-10亿元)。该公司第2款生物类似药汉曲优(曲妥珠单抗)国内市场销售收入1.095亿元,在欧盟获得的销售利润分成达2660万元,在美国和加拿大的海外授权及研发服务收入为8560万元。
国际药讯
1.三菱田边制药CD19单抗Uplizna在日本获批。日本厚生劳动省(MHLW)批准三菱田边制药靶向药Uplizna(MEDI-551,inebilizumab)上市,用于治疗视神经脊髓炎谱系障碍患者(NMOSD)。Uplizna是Viela Bio公司(已被Horizon Therapeutics收购)开发的一款CD19单抗,于去年6月在美国获得全球首批,用于一年2次维持治疗抗水通道蛋白-4(AQP4)抗体阳性的NMOSD成人患者。三菱田边制药拥有Uplizna在日本等授权区域的开发和商业化权益。
2.杨森多发性硬化症新药Ponvory欧盟即将获批。欧洲药品管理局(EMA)人用医药产品委员会(CHMP)推荐批准杨森口服选择性S1P1调节剂Ponvory(ponesimod)上市,用于治疗存在由临床或影像学特征确定的活动性复发型多发性硬化症(RMS)。在一项III期OPTIMUM研究(NCT02425644)中,与Aubagio相比,Ponvory显著降低疾病年复发率30.5%。今年3月,FDA已批准Ponvory用于治疗RMS成人患者,包括临床孤立综合征、复发-缓解型多发性硬化症、活动性继发进展型多发性硬化症。
3.罗氏Tecentriq一线治疗转移性NSCLC获欧盟CHMP推荐。欧洲药品管理局(EMA)人类使用药品委员会(CHMP)建议批准罗氏制药Tecentriq®(atezolizumab,阿特珠单抗)用于一线治疗PD-L1高表达的转移性非小细胞肺癌(NSCLC)。在一项Ⅲ期临床IMpower110中,与化疗相比,Tecentriq单药治疗可提高PD-L1高表达人群的总生存期(OS)7.1个月(OS=20.2 vs 13.1个月;危险比[HR]=0.59,95%CI:0.40–0.89;p=0.0106));而且安全性与其已知研究一致,未发现新的安全信号。
4.吉利德首创TROP-2靶向药Trodelvy欧盟进入审查。欧洲药品管理局(EMA)受理吉利德靶向抗癌药Trodelvy(SG)的营销授权申请,用于治疗至少接受过2种疗法、转移性疾病经治的局部晚期/转移三阴性乳腺癌(mTNBC)。Trodelvy是Immunomedics公司(已被吉利德收购)开发的一款首创TROP-2靶向抗体偶联药物(ADC),已于去年4月获FDA加速批准上市。目前,Trodelvy治疗mTNBC的一份补充生物制品许可申请(sBLA)正在接受FDA的审查,旨在将加速批准转为完全批准。
5.礼来超速效赖脯胰岛素Lyumjev®达III期主要终点。礼来超速效赖脯胰岛素Lyumjev®治疗2型糖尿病的III期临床 (18B-FH-ITSE)结果积极。该研究比较Lyumjev®与优泌乐®分别与基础胰岛素联用的效果。研究证实在0.4%非劣效性界值下,Lyumjev®在26周HbA1c较基线的变化非劣于优泌乐®;而且相较于优泌乐®,Lyumjev®可显著改善餐后1小时血糖波动和餐后2小时血糖波动;临床中,Lyumjev®与优泌乐®的安全性相似。Lyumjev®目前已在美国、欧盟等多国获批用于改善成人糖尿病患者的血糖控制。
6.胎盘来源NK细胞疗法获FDA快速通道认定。FDA授予Celularity公司人胎盘造血干细胞衍生的NK细胞疗法CYNK-001快速通道认证,用于治疗成年人多形性胶质母细胞瘤(GBM)。与NK细胞一样,CYNK-001具有溶细胞活性,并且在肿瘤细胞周围时会分泌包括IFN-γ在内的免疫调节细胞因子。该疗法目前正被用于多项临床试验中,包括GBM的Ⅰ期临床(CYNK001GBM01; NCT04489420)试验。该项研究计划招募36例患者,旨在确定CYNK-001的最大耐受剂量。
医药热点
1.2剂新冠疫苗接种间隔建议大于等于3周。3月28日下午,国务院联防联控机制召开新闻发布会。针对新冠疫苗接种市民关切热点问题,中国疾控中心专家王华庆表示,疫苗接种建议2剂之间的间隔大于等于3周,第2剂在8周内尽早完成;建议用同一个疫苗产品完成接种,如遇疫苗受种者异地接种等特殊情况,无法用同一个疫苗产品完成接种时,可采用相同种类的其他生产单位的疫苗产品完成接种。
2.美政府拟研发“疫苗护照”。据美国约翰斯·霍普金斯大学的实时数据显示,截至29日,美国新冠累计确诊病例已超3025万例,累计死亡逾54.9万例。目前,美国密歇根州、佛蒙特州等地的疫情出现反弹,变异病毒也在持续扩散;传染病学专家福奇警告称:放松防疫措施为时过早。此外,美国政府旨在研发一个证明个人疫苗接种的系统。截至目前,美国共有超过5100万人完成了新冠疫苗接种。
审评动向
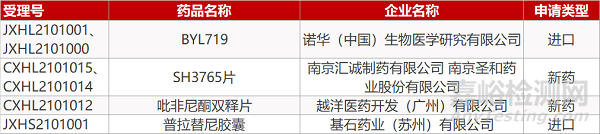
1. CDE新药受理情况(03月29日)
申请临床:
诺华的BYL719(2个规格)、汇诚制药/圣和药业的SH3765片(2个规格)、越洋医药的吡非尼酮双释片。
申请生产:
基石药业的普拉替尼胶囊。
2. FDA新药获批情况(北美03月25日)
暂无

来源:药研发