您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-19 07:27
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
君圣泰NASH新药片剂改胶囊申报临床。君圣泰自主研发的创新药HTD1801胶囊临床试验申请获CDE受理。2019年11月,该新药片剂已获得首个中国临床批件,用于治疗原发性硬化性胆管炎(PSC)。HTD1801是一种“first-in-class”新分子实体,正在全球同步进行临床开发。目前HTD1801用于非酒精性脂肪性肝炎(NASH)合并2型糖尿病的Ⅱ期临床已达到主要和次要终点,并完成用于PSC的Ⅱ期临床;FDA已授予其用于治疗NASH和PSC的快速通道资格,其中PSC还获孤儿药资格认证。此外,HTD1801还将在美国Ⅱ期临床中用于治疗罕见病原发性胆汁性胆管炎(PBC)。
国内药讯
1.君实特瑞普利单抗拟纳入突破性治疗品种。君实特瑞普利单抗(拓益)获CDE拟纳入突破性治疗品种,适应症为晚期黏膜黑色素瘤的一线治疗。拓益是首个获批的国产PD-1,已在中国获批用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤,以及既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌(NPC)患者。在美国,FDA已授予特瑞普利单抗联合阿昔替尼一线治疗黏膜黑色素瘤的快速通道资格。
2.辉瑞JAK1抑制剂拟纳入优先审评。辉瑞阿布昔替尼片(abrocitinib)上市申请以“符合儿童生理特征的儿童用药品新品种、剂型和规格”为由被CDE纳入拟优先审评公示名单,适应症为用于治疗12岁及以上中重度特应性皮炎(AD)患者,包括缓解瘙痒。Abrocitinib是一种口服小分子选择性JAK1抑制剂,其用于治疗12岁及以上中重度AD患者的新药申请已获FDA优先审评资格,预计今年4月获FDA批准上市。
3.诺和诺德长效胰岛素在华启动临床。诺和诺德icodec胰岛素在中国登记启动了一项临床研究。这是一项单臂、开放、Ⅰ期试验,旨在评估这款一周一次长效胰岛素在中国2型糖尿病受试者中的安全性和耐受性,以及药代动力学特征。主要研究者为中国人民解放军总医院王睿教授,中国人民解放军总医院副主任药师梁蓓蓓博士。该研究计划在中国境内入组20人。
4.宝船生物创新药新靶点抗体获临床批件。宝船生物自主开发的“BC006单抗注射液”获CDE批准临床。这是一款CSF-1R靶向人源化IgG1单抗,特异性靶向作用于单核-巨噬细胞系膜表面的CSF-1R,抑制其二聚化并阻断下游细胞内信号通路活化,从而减少肿瘤微环境中免疫抑制性M2样巨噬细胞数量,恢复巨噬细胞功能,产生抗肿瘤作用。该新药拟用于治疗晚期恶性肿瘤,BC006也是我国首个进入临床开发的CSF-1R抗体。
5.辉瑞口服小分子GLP1A在国内获批临床。辉瑞1类创新药PF-06882961片(danuglipron)获国家药监局临床试验默认许可,拟开展治疗2型糖尿病的临床研究。danuglipron是一款口服小分子GLP-1受体激动剂,目前处于II期临床开发阶段,其评估danuglipron治疗糖尿病的概念验证结果有望在第三季度获得。该公司还将启动IIb期临床试验,检验这款新药治疗非酒精性脂肪性肝炎(NASH)患者的潜力。
6.国内首款鼻喷式新冠疫苗将申报临床。青岛海华生物研发的鼻喷式粘膜免疫新冠疫苗即将完成灵长类动物试验,计划近期申报开展临床。这是一款基于副粘病毒为载体的核酸疫苗,已在动物试验中显现出抗体产生快、可迅速普及免疫等特点。与国内获批的4款新冠疫苗通过肌肉注射来实现细胞免疫和体液免疫不同,该疫苗直接喷在鼻腔粘膜上,它能够产生粘膜免疫、细胞免疫和体液免疫来阻断病毒的感染。目前国内外至少有7种鼻喷式新冠疫苗正在研发或进入临床阶段。
国际药讯
1.默沙东HIV新药被强制许可。厄瓜多尔国家知识产权局日前宣布对默沙东(MSD)抗HIV药物拉替拉韦(Raltegravir,Isentress®,艾生特®)的一项专利实施强制许可,授权厄瓜多尔制药公司SoulPharma可以从印度制药商进口拉替拉韦仿制药,该仿制药仅限在厄瓜多尔国内市场销售。强制许可有效期直至该药物的专利权期限(2022年10月21日)。拉替拉韦是一种HIV整合酶抑制剂,最早于2007年10月在美国获批,主要适应症是HIV-1感染。
2.默沙东Keytruda欧盟获批首个儿科适应症。欧盟委员会批准默沙东(MSD)公司PD-1疗法Keytruda(pembrolizumab)标签扩展,单药用于治疗3岁及以上、自体干细胞移植失败、或在至少接受过2种疗法的复发或难治性经典霍奇金淋巴瘤成人和儿童患者。这也Keytruda在欧盟的首个儿科批准。在一项Ⅲ期临床KEYNOTE-204研究中,与brentuximab vedotin(BV)相比,Keytruda将疾病进展或死亡风险降低了35%(HR=0.65[95%CI:0.48-0.88];p=0.0027),两组患者中位PFS分别为13.2个月和8.3个月。
3.礼来公布CDK4/6抑制剂Verzenio的Ⅲ期临床数据。在2021年第17届圣加伦国际乳腺癌大会上,礼来(Eli Lilly)制药公布口服CDK4/6抑制剂Verzenio(abemaciclib)联合标准内分泌疗法(ET)治疗HR +、HER2-高危早期乳腺癌的Ⅲ期研究monarchE积极结果。接受中位随访19.1个月后,与ET治疗相比,Verzenio联合疗法将乳腺癌复发风险显著降低了28.7%(HR=0.713;95%CI:0.583,0.871;p=0.0009),达到无侵袭性疾病生存(IDFS)的主要终点。去年12月,该药物已在中国获批,商品名为Abemaciclib。
4.罗氏脊髓性肌萎缩症新药Evrysdi获长期疗效数据。罗氏(Roche)SMN2基因剪接调节剂Evrysdi(risdiplam)治疗2型或卧床3型脊髓性肌萎缩症(SMA)患者(2-25岁)的SUNFISH研究获2年长期疗效数据。在主要和次要终点测量中,12个月时Evrysdi治疗观察到的运动功能改善在24个月时继续改善或维持。根据疾病自然史,2型和3型SMA患者在未经治疗时,运动功能会随着时间的推移而下降。详细数据将于MDA2021会议上公布。
5.创新胃癌抗体偶联药物获FDA孤儿药资格。FDA授予Ambrx公司HER2靶向抗体偶联药物(ADC)ARX788孤儿药资格,用于治疗HER2阳性胃癌和胃食道结合部癌。目前正在进行的Ⅰ期临床试验显示,在曾经接受过曲妥珠单抗和化疗治疗的转移性胃癌患者中,ARX788表现出积极的抗癌活性。该公司计划今年下半年启动评估ARX788二线治疗HER2阳性胃癌的国际Ⅲ期临床。此前,ARX788已获得FDA授予的用于治疗HER2阳性乳腺癌的快速通道资格。
6.艾伯维乌帕替尼补充申请审查遭FDA延期。FDA延长对艾伯维(AbbVie)抗炎药RINVOQ (Upadacitinib)用于治疗成人活动性银屑病关节炎(PsA)的补充申请的审查期, PDUFA日期延长三个月至2021年第二季度末。FDA计划对这款口服JAK抑制剂治疗银屑病关节炎的益处风险状况进行全面评估,目前艾伯维已按要求提交了相关资料。另外,FDA关于在治疗特应性皮炎中使用RINVOQ补充新药申请也有类似请求,艾伯维目前正在准备相关资料。
7.蛋白降解疗法初创公司完成B轮融资。Amphista公司宣布完成5300万美元的B轮融资。本轮融资由Forbion和Gilde Healthcare领投,诺华风投基金和礼来等公司参投。获得的资金将用于扩展该公司的下一代靶向蛋白降解平台,并加快介导靶向蛋白降解的双特异性分子研发管线的开发。Amphista公司旨在从三个方面改进蛋白降解疗法:扩展蛋白降解疗法的靶点范围,降低对蛋白降解疗法的潜在耐药性,以及让蛋白降解剂更具有成药特性。
医药热点
1.儿童肿瘤救治管理病种增加。国家卫健委5部门联合发布《关于进一步扩大儿童血液病恶性肿瘤救治管理病种范围的通知》,将中枢神经系统肿瘤、恶性生殖细胞瘤、头颈胸部肿瘤、神经纤维瘤病、朗格罕细胞组织细胞增生症、免疫性溶血性贫血等12个病种纳入儿童血液病恶性肿瘤救治管理病种范围。鼓励各地在此基础上,结合当地实际,将本地区多发、群众反映强烈的儿童重大疾病病种纳入救治管理范围。
2.医学研究伦理审查办法征求意见。国家卫健委发布《关于涉及人的生命科学和医学研究伦理审查办法(征求意见稿)》提出,所有涉及人的生命科学和医学研究活动均应接受伦理审查;开展涉及人的生命科学和医学研究的二级以上医疗机构和设区的市级以上卫生机构(包括疾病预防控制、妇幼保健、采供血机构等)、高等院校、科研院所等机构是伦理审查工作的管理责任主体,应当设立伦理审查委员会。《意见稿》还明确了研究活动的界定范围。
3.法国发现可逃避核酸检测的变异新冠病毒。法国16日宣布,法国布列塔尼大区阿摩尔滨海省拉尼用医院发现一种新的变异新冠病毒。携带这一变异新冠病毒的8例患者来自于一家企业聚集性感染事件,他们有典型的感染症状,但其鼻咽样本核酸测试(PCR检测)结果呈阴性,后经巴斯德研究所进一步的基因检测,在样本中发现了新的变异新冠病毒,该变异株的S蛋白以及其他病毒区域中共携带9个突变。法国卫生当局对此进行调查并已上报世卫组织(WHO)。
4.礼来任命蒋逸飞为糖尿病产品事业部副总裁。礼来宣布晋升蒋逸飞为礼来中国糖尿病产品事业部副总裁,自4月1日起生效。据悉,蒋逸飞现任礼来南非和撒哈拉以南非洲市场营销总监,他是2009年通过MBA项目加入礼来希爱力全球营销团队的,2010年加入礼来中国后,历任医药代表、希爱力品牌经理、骨松品牌负责人以及肿瘤事业部高级区域销售经理。
审评动向
1. CDE新药受理情况(03月1日)

申请临床:
百济神州的替雷利珠单抗注射液、 君圣泰的HTD1801胶囊。
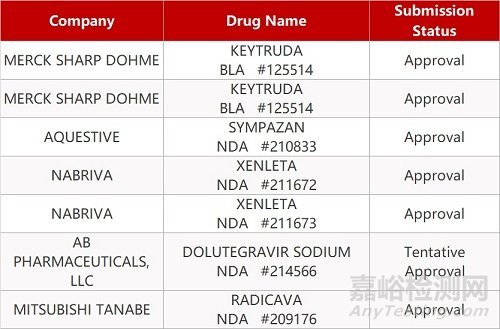
2. FDA新药获批情况(北美03月16日)
股市资讯
【博瑞医药】全资子公司博瑞制药(苏州)有限公司的奥拉西坦注射液获得药品注册证书。
【卫信康】全资子公司内蒙古白医制药股份有限公司的混合糖电解质注射液药品注册申请变更为“制证完毕-待发批件”。
【奥赛康】子公司江苏奥赛康药业有限公司与上海药明康德新药开发有限公司签订《合作开发合同书》,合作用于Exon14突变及第三代EGFR抑制剂耐药性的NSCLC治疗的一类新药开发。

来源:药研发


